
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学力程式为______________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为____________________________。
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
(5)如图是在酸性电解质溶液中,以情性材料作电极,将CO2转化为丙烯的原理模型。
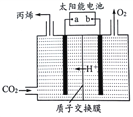
①太阳能电池的负极是_________。(填“a”或“b”)
②生成丙烯的电极反应式是____________________________。
【答案】 ![]() NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol 0.0125mol/(L·min) < 60% 1×10-5 a 3CO2+18H++18e-=C3H6+6H2O
NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol 0.0125mol/(L·min) < 60% 1×10-5 a 3CO2+18H++18e-=C3H6+6H2O
【解析】本题综合考查化学反应原理,涉及的考点有电子式的书写、电极反应式的书写、化学防御速率、化学平衡常数等。(1)三氯化氮原子均满足8e-结构,故电子式为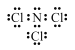 ;氯化铵与氯气生成三氯化氮,其方程式为:NH4Cl+3Cl2=NCl3+4HCl;(2) 根据序号1的热化学方程式为:2CO2(g)+3NaOH(aq) =NaHCO3(aq)+ Na2CO3(aq)+H2O(l) △H= -4akJ/mol、序号2的热化学方程式为CO2(g)+2NaOH(aq) = Na2CO3(aq)+H2O(l) △H= -bkJ/mol,根据盖斯定律可得:NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol;(3)①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO) = v(CO)=(2.00mol-1.5mol)÷1L÷40min= 0.0125mol/(L·min);②根据甲乙容器可知,乙容器80min达到平衡,甲容器在120min达到平衡,故乙容器的温度高于甲容器,温度高CO的平衡浓度大,平衡逆向移动,所以该反应属于放热反应,△H<0;③甲与丙的温度一样,故平衡常数不变。甲容器在300℃下的平衡常数为:
;氯化铵与氯气生成三氯化氮,其方程式为:NH4Cl+3Cl2=NCl3+4HCl;(2) 根据序号1的热化学方程式为:2CO2(g)+3NaOH(aq) =NaHCO3(aq)+ Na2CO3(aq)+H2O(l) △H= -4akJ/mol、序号2的热化学方程式为CO2(g)+2NaOH(aq) = Na2CO3(aq)+H2O(l) △H= -bkJ/mol,根据盖斯定律可得:NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol;(3)①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO) = v(CO)=(2.00mol-1.5mol)÷1L÷40min= 0.0125mol/(L·min);②根据甲乙容器可知,乙容器80min达到平衡,甲容器在120min达到平衡,故乙容器的温度高于甲容器,温度高CO的平衡浓度大,平衡逆向移动,所以该反应属于放热反应,△H<0;③甲与丙的温度一样,故平衡常数不变。甲容器在300℃下的平衡常数为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol/L) 2 2 0 0
变化(mol/L) 1.2 1.2 1.2 1.2
平衡(mol/L) 0.8 0.8 1.2 1.2 K=4.21875
丙容器在300℃下的平衡常数为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol/L) 1 1 0 0
变化(mol/L) 2x 2x x 2x
平衡(mol/L) 1-2x 1-2x x 2x K=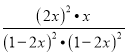 =4.21875,
=4.21875,
解得x=0.3mol/L,故丙容器达到平衡时,CO的转化率为60%;
(4) NH4++C2O42-+H2O![]() NH3·2H2O+HC2O4-的平衡常数K=
NH3·2H2O+HC2O4-的平衡常数K=![]() =
=
![]() =1×10-5;
=1×10-5;
(5) ①由图片可知,与a相连的电极:CO2→丙烯,发生还原反应,作阴极,故a为太阳能电池的负极;②生成丙烯的电极反应式为:3CO2+18H++18e-=C3H6+6H2O。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】常温下,将pH=3 的硫酸与pH=9的NaOH 溶液混合,若要得到pH=7 的溶液,混合时硫酸酸与NaOH溶液的体积比为( )
A.1:200
B.200:1
C.100:1
D.1:100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:
(1)单质M的晶体类型为 , 晶体中原子间通过作用形成面心立方密堆积,其中M原子的配位数为 .
(2)元素Y基态原子的核外电子排布式为 , 其同周期元素中,第一电离能最大的是(写元素符号).元素Y的含氧酸中,酸性最强的是(写化学式),该酸根离子的立体构型为 .
(3)M与Y形成的一种化合物的立方晶胞如图所示. 
①该化合物的化学式为 , 已知晶胞参数a=0.542nm,此晶体的密度为gcm﹣3 . (写出计算式,不要求计算结果.阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是 . 此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.![]()
B.(2b﹣a)mol/L
C.![]()
D.(10b﹣5a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
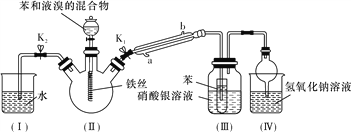
请回答下列问题:
(1)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。装置Ⅱ中生成有机物的反应为__________________________________________(填化学方程式),装置Ⅲ中小试管内苯的作用是__________________________________。
(2)能说明苯与液溴发生了取代反应的现象是_____________________。
(3)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法__________。
(4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤、振荡、分液;②用5%的NaOH溶液洗涤、振荡、分液;③用蒸馏水洗涤、振荡、分液;④加入无水CaCl2粉末干燥;⑤_______________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
A.PCl3中P原子sp3杂化,为三角锥形
B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S分子中,S为sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分析正确的是
A. 异丁烷的二氯代物有4种
B. 区别蛋白质和淀粉可用浓硝酸做颜色反应
C. 石蜡油分解产物均能使酸性KMnO4溶液褪色
D. 甲苯的硝化反应方程式为: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是( )
A.明矾可用作净水剂
B.甲醛可用作食品防腐剂
C.氢氧化钠可用来治疗胃酸过多
D.铝制容器可长期存放酸性食物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com