
【题目】下列分析正确的是
A. 异丁烷的二氯代物有4种
B. 区别蛋白质和淀粉可用浓硝酸做颜色反应
C. 石蜡油分解产物均能使酸性KMnO4溶液褪色
D. 甲苯的硝化反应方程式为: ![]()
【答案】B
【解析】A项,异丁烷为CH3CH(CH3)CH3,其二氯代物中,取代同一碳原子上的2个H原子有:CH3CH(CH3)CHCl2;取代不同碳原子上的2个H原子有:ClCH2CH(CH3)CH2Cl,ClCH2CCl(CH3)CH3,所以共有3种,故A错误;B项,浓硝酸可与蛋白质发生颜色反应,显黄色,而淀粉不具有这样的性质,所以可用浓硝酸做颜色反应来区别蛋白质和淀粉,故B正确;C项,石蜡油分解的产物主要是烯烃和烷烃的混合物,烯烃能使酸性KMnO4溶液褪色,而烷烃不能使酸性KMnO4溶液褪色,故C错误;D项,甲苯的硝化反应为:甲苯、浓硝酸与浓硫酸共热至55℃~60℃,生成硝基苯和水,所以甲苯的硝化反应需要浓硫酸而不是稀硫酸,故D错误。


科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)实验数据如下表:
①请填写下表中的空白:________。
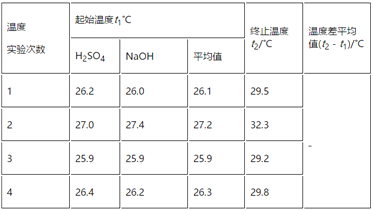
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是(______)。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学力程式为______________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为____________________________。
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
(5)如图是在酸性电解质溶液中,以情性材料作电极,将CO2转化为丙烯的原理模型。
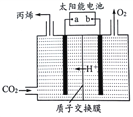
①太阳能电池的负极是_________。(填“a”或“b”)
②生成丙烯的电极反应式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2﹣氯丙烷制得少量的HOCH2CH(OH)CH3 需要经过下列几步反应( )
A.消去→加成→水解
B.加成→消去→取代
C.取代→消去→加成
D.消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C![]() Li1-xCoO2+LixC6。示意图如右。下列说法正确的是
Li1-xCoO2+LixC6。示意图如右。下列说法正确的是

A. 充电时,阳极的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2
B. 该装置工作时涉及到的能量形式有3种
C. 充电时锂离子由右向左移动
D. 放电时,正极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的表述确切的是( )
A. 焰色反应是元素的特有性质
B. 焰色反应是单质的特有性质
C. 焰色反应是离子的特有性质
D. 焰色反应是化合物的特有性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出. 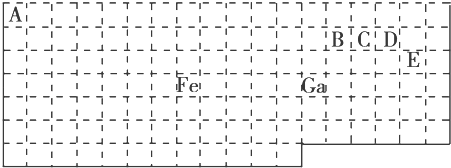
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的区;Fe和CO易形成配合物Fe(CO)5 , 在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为和(填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 . B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为(写2种).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com