
| A、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| B、使用pH试纸测定未知气体的酸碱性时,不能用蒸馏水润湿试纸 |
| C、将20g KNO3完全溶于80 mL水中,配制质量分数约为20%的KNO3溶液 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应恰好相等 |


科目:高中化学 来源: 题型:
| A、CH3COOH?CH3COO-+H+ |
| B、Fe2(SO4)3═2Fe2++3SO42- |
| C、Ba(OH)2═Ba2++2OH- |
| D、NaHCO3═Na++HCO3- |
| E、NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液漏斗进行分液操作,将甘油和水的混合物分离 |
| B、从溴的四氯化碳溶液中提取溴,可用苯进行萃取 |
| C、用热的浓HCl洗涤附着有MnO2的试管 |
| D、在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 |
| E、用碱式滴定管量得KMnO4溶液20.50mL |
| F、实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置 |
| G、只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别 |
| H、用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管插入FeSO4溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| B、c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) |
| C、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| D、c(CH3COO-)═c(Cl-)═c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
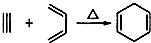 ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 实验现象 | 结论 |
| A | 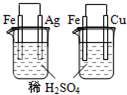 烧杯中银表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Fe>Cu>Ag |
| B |  边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C |  淡黄色固体先变为白色,后变为黑色 | 溶解性:AgCl>AgBr>Ag2S |
| D | 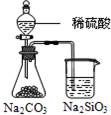 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
| A、A | B、B | C、B | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com