
| ||
| x |
| 2 |
| ||
| 3 |
| 2 |
| x |
| 2 |
| 3 |
| 2 |
| x |
| 2 |
| 3 |
| 2 |
| V(CO) |
| V(H2) |
| a-10 |
| 20-a |
| a-10 |
| 20-a |


科目:高中化学 来源: 题型:
| A、0.12 mol |
| B、0.1 mol |
| C、0.11 mol |
| D、0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| B、使用pH试纸测定未知气体的酸碱性时,不能用蒸馏水润湿试纸 |
| C、将20g KNO3完全溶于80 mL水中,配制质量分数约为20%的KNO3溶液 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应恰好相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C≡O (CO) | C=O | H-O | H-H |
| 键能(kJ?mol-1) | 1070 | 801 | 463 | 436 |
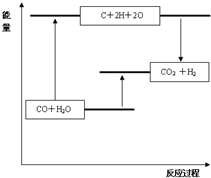 B.
B.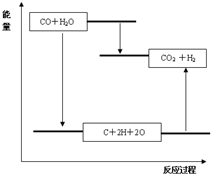
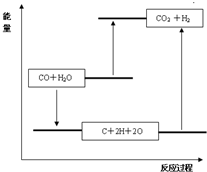 D.
D.
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| M |
| m(总) |
| n(总) |
. |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com