分析:(1)依据反应焓变=反应物键能总和-生成物键能总和得到反应能量变化;可能反应不能进行彻底分析判断反应放出热量;依据反应是吸热反应方向判断反应物能量低于生成物能量判断;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式,平衡标志是正逆反应速率相同,各组分含量保持不变分析判断选项;
(3)依据化学平衡三段式列式计算,反应速率v=
得到反应速率,结合反应前后气体体积不变的反应方向判断;
解答:
解:(1)反应H
2O(g)+CO(g)?CO
2(g)+H
2(g),焓变△H
3=2×463KJ/mol+1070KJ/mol-2×801KJ/mol-436KJ/mol=+42KJ/mol;在一密闭容器中加入1mol H
2O(g)和1mol CO(g)充分反应吸热,反应为可逆反应,吸收的热量小于MKJ;
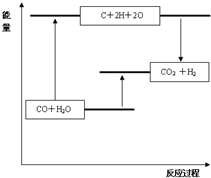
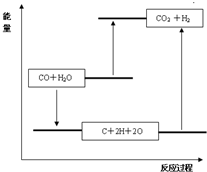
A、图A中符合其能量变化,反应物能量低于生成物,故A符合;
B、图象中断裂化学键需要吸收能量,所以分子能量低于原子能量,故B错误;
C、生成物分子断裂化学键为原子吸收能量,故C错误;
D、图象中反应物能量高于生成物,不是吸热过程,故D错误;
故答案为:吸热,<,A;
(2)二甲醚(DME)水蒸气重整制氢是一种有效解决氢源的方案,其包含的化学反应有:
①CH
3OCH
3(g)+H
2O(g)=2CH
3OH(g)△H
1=24.52kJ?mol
-1②CH
3OH(g)=CO(g)+2H
2(g)△H
2=90.73kJ?mol
-1③H
2O(g)+CO(g)=CO
2(g)+H
2(g)△H
3=42kJ?mol
-1结合盖斯定律计算①+②×2+③×2得到:CH
3OCH
3(g)+3H
2O(g)=2CO
2(g)+6H
2(g)△H=289.98KJ/mol;
CH
3OCH
3(g)+3H
2O(g)=2CO
2(g)+6H
2(g)反应是气体体积增大的吸热反应反应的平衡状态时正逆反应速率相同,各组分含量保持不变;
A.反应前后气体体积变化,容器内气体压强不再发生改变,说明反应达到平衡状态,故A正确;
B.反应速率之比等于化学方程式计量数之比,是正反应速率之比,6v(CH
3OCH
3)=v(H
2),不能说明反应达到平衡状态,故B错误;
C.反应前后气体质量相同,体积相同,各组分的密度始终不发生改变,不能说明反应达到平衡状态,故C错误;
D. n(CH
3OCH
3):n(H
2O):n(CO
2):n(H
2)=1:3:2:6,是反应物质的量之比,不能说明反应达到平衡状态,故D错误;
E.CO
2的体积分数为
,体积分数不变,说明反应达到平衡状态,故E正确;
故答案为:AE;
(3)已知CH
3OCH
3(g)+H
2O(g)?2CH
3OH(g),一定温度下在一2L密闭容器中充入0.1mol CH
3OCH
3(g)和0.2mol H
2O(g)发生该反应,依据化学平衡三段式列式,设反应甲醚物质的量为x;
CH
3OCH
3(g)+H
2O(g)?2CH
3OH(g),
起始量(mol) 0.1 0.2 0
变化量(mol) x x 2x
平衡量(mol)0.1-x 0.2-x 2x
经过5min达到平衡,此时CH
3OCH
3(g)的物质的量分数为10%,
×100%=10%
x=0.07mol
则用CH
3OH (g)表示的平均反应速率=
=0.014mol/L?min;
反应前后去体积不变,所以与反应前容器内压强相比反应后容器内压强不变;
故答案为:0.014mol/L?min,不变;

 B.
B.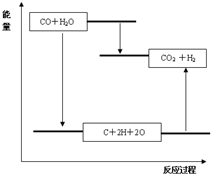
 D.
D.


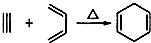 ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是