
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:

(1)操作①为____________;
(2)操作②~④加入的试剂可以为 。
(3)如何判断SO![]() 已除尽,简述实验操作 ;
已除尽,简述实验操作 ;
(4)实验过程中产生的多次沉淀_________(填“需要”或“不需要”)多次过滤,理由 。
(5)该同学设计的实验方案____________(填“合理”或“不合理”),理由是 。
【答案】(1)(加水)溶解(2分)
(2)Ba(NO3)2、K2CO3、KOH[或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3](2分)
(3)取少许滤液(1分),先加入盐酸酸化,再向其中加入少量Ba(NO3)2溶液(1分),若不变浑浊,表明SO42-已除尽 (1分)(共3分)
(4)不需要(1分)生成的沉淀可一次性过滤,如果分步过滤会使操作复杂化(1分)
(5)不合理(1分)调节溶液的pH不能用盐酸,而应该用硝酸,否则会引入Cl-(1分)
【解析】
试题分析:沉淀反应必须在溶液中进行,以便充分反应,并使杂质完全沉淀,所以首先应当将固体配制成溶液。除去SO42-、Mg2+的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的Ba(NO3)2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,同时要注意不可加入BaCl2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调节溶液的pH,否则会引进Na+和Cl-杂质。


科目:高中化学 来源: 题型:
【题目】生物界与非生物界具有统一性,是因为
A. 构成细胞的化合物在非生物界都存在
B. 构成细胞的无机物在非生物界都存在
C. 构成细胞的化学元素在非生物界都存在
D. 生物与非生物都具有新陈代谢的功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I均为有机物,根据下列框图和已知条件回答问题:

已知:A中有一个甲基,D都能使溴水褪色,F能发生银镜反应,I的结构简式为: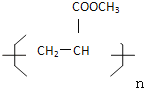
请回答下列问题:
(1)A中含有的官能团: (文字叙述)
(2)属于取代反应的有:
(3)写出反应④的化学方程式
(4)写出A的结构简式
(5)E有多种同分异构体,其中一种既能发生银镜反应又能和NaOH溶液反应,请写出它的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g/cm3),所得溶液的密度为ρg/cm3,质量分数为ω,物质的量浓度为cmol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度:c=1 mol/L
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:ω=36.5c/1 000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素的论述中,正确的是( )
A. 在组成生物体和无机自然界的化学元素中,碳元素的含量最高
B. 人、动物与植物中所含的化学元素种类差异很大
C. 组成生物体的化学元素在无机自然界中都可以找到
D. 不同生物体内各种化学元素的含量比例基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
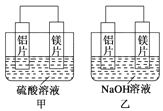
(1)写出甲中正极的电极反应式___________________。
(2)乙中总反应的离子方程式:________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出_____________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有______________。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中,发生反应:H2(g)+CO(g)![]() C(s)+H2O(g)。初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法中不正确的是( )
C(s)+H2O(g)。初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法中不正确的是( )
A.反应前后气体的压强之比为4:3
B.反应前后气体的密度之比为15:16
C.H2与CO的转化率相等,均为50%
D.若H2与CO按8:5体积比混合,则反应前后混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硫酸
分子式:H2SO4
相对分子质量:98
密度:1.84g/mL
H2SO4的质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为 。
(2)某学生欲用上述浓硫酸和蒸馏水配制250mL物质的量浓度为0.4 mol·L-1的稀硫酸,该学生需要量取 mL上述浓硫酸进行配制。
(3)为配制(2)中的稀硫酸,下列可供选用的仪器中,一定用到的是 (填编号),配制过程中还缺少的仪器是 。(填写仪器名称)
①玻璃棒; ②胶头滴管;③量筒;④药匙;⑤圆底烧瓶;⑥天平;⑦烧杯;⑧普通漏斗
(4)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是 (填序号)。
①定容时俯视观察
②定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
③浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
④容量瓶使用时未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学们对SO2与漂粉精、过氧化钠的反应进行实验探究:
【实验I】SO2与漂粉精反应。
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为__________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是____________。
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?____________请说明理由____________________。
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。该反应的离子方程式为______________。
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是____________(填化学式);
② 用离子方程式解释现象3中黄绿色褪去的原因____________________。
【实验II】SO2与过氧化钠反应。将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好。在室温下按图示装置进行实验,请填写空白。
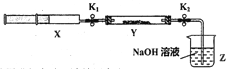
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)_______ | (2)反应的化学方程式:_________________ |
将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)________ | (4)不用解释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com