
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�������˾���þƬ����Ƭ���缫������ͬѧ���缫����6 mol��L��1��H2SO4��Һ������ͬѧ���缫����6 mol��L��1��NaOH��Һ������ͼ��ʾ��
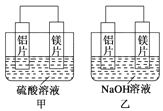
��1��д�����������ĵ缫��Ӧʽ___________________��
��2�������ܷ�Ӧ�����ӷ���ʽ��________________________��
��3�����������ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ������á�������жϳ� ��Ը�ǿ�����һ��жϳ�_____________��Ը�ǿ��(��дԪ�ط���)
��4���ɴ�ʵ��ó������н���������ȷ����______________��
A������ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
B��þ�Ľ����Բ�һ�������Ľ�����ǿ
C����ʵ��˵���������˳����ѹ�ʱ��û��ʵ�ü�ֵ��
D����ʵ��˵����ѧ�о������ӡ���Ӧ������Ӱ��ϴ���Ӧ��������������
���𰸡���1��2H����2e��==H2����2��2Al��2OH����2H2O==2AlO2-��3H2��
��3��Mg Al��4��AD
��������
�����������1������þ��ʧ������������Al��������������þ����������Ӧ�������������ӷ�����ԭ��Ӧ��������ӦΪ2H++2e-=H2����������ӦΪMg-2e-=Mg2+��
��2���ҳ�������ʧ������������þ����������������ʧ���ӷ���������Ӧ������ܷ�ӦΪ��2Al��2OH����2H2O==2AlO2-��3H2����
��3������þ���������������������������������Ľ���������ǿ�жϣ�����þ���ǿ�����������ǿ��
��4��A�����ݼס����е缫��Ӧʽ֪��ԭ�����������������Һ�йأ�����ȷ��B��þ�Ľ����Դ���������ʧ�������׳̶���������Һ�йأ��ʴ���C����ʵ����о����ʵ�������ʵ�ü�ֵ���ʴ���D����ʵ��˵����ѧ�о������ӣ���Ӧ�������йأ��缫������ͬ�䷴Ӧ������ͬ��������ﲻͬ������Ӧ��������������������ȷ����ѡAD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������ֽ����������֯���Ƹ����ҵ����Ҫԭ�ϡ���ҵ̼����(����Լ98%)�к���Ca2����Mg2����Fe3����Cl����SO42�������ʣ��ᴿ�����������£�
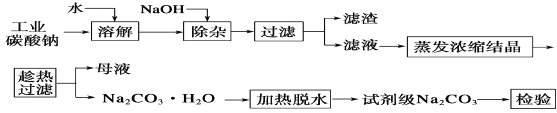
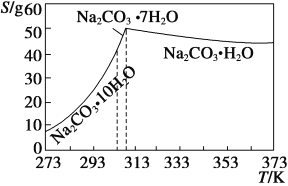
��֪̼���Ƶ��ܽ��(S)���¶ȱ仯����������ͼ��ʾ��
�ش�����������
��1����������Ҫ�ɷ�Ϊ_______________________________��
��2�������ȹ�������ԭ����___________________________��
��3������ʵ���ҽ��������ȹ��������ɲ�ȡ�Ĵ�ʩ��_____(д��һ��)��
��4����֪��Na2CO3��10H2O (s)===Na2CO3(s)��10H2O(g) ��H1�� +532.36 kJ��mol��1
Na2CO3��10H2O(s)===Na2CO3��H2O(s)��9H2O(g) ��H2�� +473.63 kJ��mol��1
д��Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж����������Ļ�ѧԪ�غͻ��������������ȷ����
A. ����ϸ���к������Ļ������ǵ�����
B. ��ɺ��Ǻͺ���Ļ�ѧԪ����ȫ��ͬ
C. ø�ͺ��ᶼ�Ǻ���NԪ�ص���������
D. �ˡ�������ֲ�������Ļ�ѧԪ�ص��������ܴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ҫ0��80 mol��L-1NaOH��Һ475 mL��0��40 mol��L-1������Һ500 mL��������������Һ����������ش��������⣺
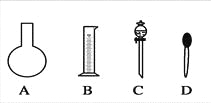
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����________������ţ�������������Һ�����õ��IJ���������________�����������ƣ���
��2�����в����У�����������ƿʵ�ֵ���______________������ţ���
A������һ�����ȷŨ�ȵı���Һ |
B����ȡһ�������Һ�� |
C����������ƿ������µ����������Һ�� |
D��ȷϡ��ijһŨ�ȵ���Һ |
E��������Һ
F�����������ܽ��������
��3�����ݼ�����������ƽ��ȡNaOH������Ϊ___________g����ʵ����������������ȷ��������ʱ���ӿ̶��ߣ���������ҺŨ��_________��������������������������С��������ͬ��0��8 mol��L-1��������ʱ������������ˮ����������ƿ�⣬��������ҺŨ��__________0.8 mol��L-1��
��4�����ݼ����֪��������������Ϊ98 %���ܶ�Ϊ1��84 mol��L-1��Ũ��������Ϊ__________mL������������һλС���������ʵ������10 mL��15 mL��20 mL��50 mL��Ͳ��ѡ��___________mL��Ͳ��á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˽�����K2SO4��MgSO4��KNO3�����ᴿ�����Ƶô�����KNO3��Һ��ijͬѧ�������ʵ�鷽����

��1��������Ϊ____________��
��2�������ڡ��ܼ�����Լ�����Ϊ ��
��3������ж�SO![]() �ѳ���������ʵ����� ��
�ѳ���������ʵ����� ��
��4��ʵ������в����Ķ�γ���_________(���Ҫ������Ҫ��)��ι��ˣ����� ��
(5)��ͬѧ��Ƶ�ʵ�鷽��____________(���������������)�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ��������������У�����Է������±仯���䷴Ӧ���̺�������ϵ��ͼ1��ʾ����SO2(g)+1/2O2(g)![]() SO3(g) ��H=��98.45kJ��mol��1��
SO3(g) ��H=��98.45kJ��mol��1��
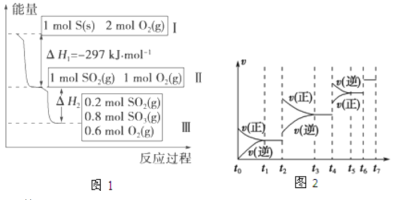
��1����ȼ�յ��Ȼ�ѧ����ʽΪ ��
��2�����������£����д�ʩ����ʹn(SO3)/n(SO2)��ͼ1��ʾ���������� ��
A�������¶� B������He C���ٳ���1mol SO2(g)��1mol O2(g) D��ʹ�ô���
��3�����º���ʱ��ͼ1��II��III��Ӧ�ų���������1mol SO2��2mol O2��ַ�Ӧ�ų������� ����
�������������������������
��4��ijSO2(g)��O2(g)��ϵ��ʱ��t1�ﵽƽ��ı�ijһ�����������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ2��ʾ�������ı�SO2(g)��O2(g)��������ͼ��t2ʱ����ƽ���ƶ������������� ��ͼ�б�ʾƽ��������SO3�ĺ�����ߵ�һ��ʱ���� ������t1��t2��t3��t4��t5��t6��t6��t7�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2�ɽ���ҵ�����е�NO����ԭ��N2��������ת����ϵ��ͼ(ͼ�м�����λΪmol), ��NO(g)+H2(g)=![]() N2(g)+H2O(g)����HΪ�� ��
N2(g)+H2O(g)����H�� ��

A��0.5(a+b-c-d)kJ/mol B��0.5(c+a-d-b)kJ/mol
C��0.5(c+d-a-b)kJ/mol D. 0.5(c+d-a-b)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ���� ( )
A����ҵ�ϴֹ���Ʊ���SiO2��C![]() Si+CO2��
Si+CO2��
B��Cu2O��ϡH2SO4��Ӧ��Cu2O��2H+=2Cu+��H2O
C����ϡ����ϴ���Թ��ڱڵ�������3Ag+4H++NO3��=3Ag++NO��+2H2O
D.��Mg(HCO3)2��Һ�м������ռ���Һ:Mg2��+2HCO3��+2OH��=MgCO3��+2H2O+CO32��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com