
科学家指出:多种海产品如虾、蟹、牡蛎等体内含有+5价的砷(As)元素,它对人体是无毒的,吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:“大量海鲜+大量维生素C = 砒霜(As2O3)”,这说明维生素C具有
A.氧化性 B.还原性 C.酸性 D.碱性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年湖南省益阳市高一上学期期中考试化学卷(解析版) 题型:选择题
下列说法正确的是
A.硫酸、纯碱、硝酸钠和生石灰分别属于酸、碱、盐和氧化物
B.根据元素种类的多少将物质分为纯净物和混合物
C.通常情况下,若发生反应A2 + 2B-= 2A-+ B2,则氧化剂是A2
D.碳酸氢钠在水中的电离方程式:NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气。松油醇结构如图所示,下列有关松油醇的叙述正确的是

A.松油醇的分子式为C10H20O
B.它属于芳香醇
C.松油醇分子在核磁共振氢谱中有7个吸收峰
D.松油醇能发生消去反应、还原反应、氧化反应、酯化反应
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高一上学期期末化学试卷(解析版) 题型:实验题
(16分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
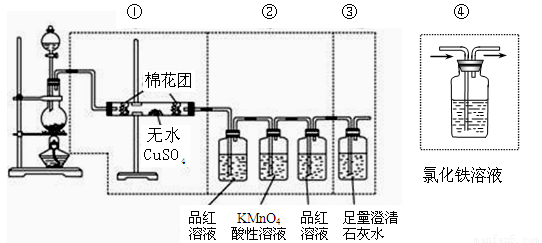
(1)写出木炭粉与浓硫酸反应的化学方程式 ;
(2)如果按装置中三部分仪器的连接顺序进行实验。
i.装置①出现 现象说明有 生成;
ii.装置②中前一瓶品红溶液褪色,说明有 生成;
iii.能检验出最后一种产物的现象是 ;
(3)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是 ;不能确定的物质是 ;
(4)若将①、②、③装置拆除,替换装置④进行实验。
装置④中溶液颜色变浅绿色, 其反应的离子方程式是 ;
反应后往④中溶液加入氯化钡溶液,反应的离子方程式是 ;
(5)若④中的氯化铁溶液含有少量的亚铁离子,为检验少量亚铁离子的存在,可选用的试剂是 。
A.KSCN溶液 B.稀盐酸 C.KMnO4 溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
根据以下几个反应:
①Cl2+2KI 2KCl+I2 ②2FeCl2+Cl2
2KCl+I2 ②2FeCl2+Cl2 2FeCl3
2FeCl3
③2FeCl3+2KI 2FeCl2+2KCl+I2 ④I2+SO2+2H2O
2FeCl2+2KCl+I2 ④I2+SO2+2H2O H2SO4+2HI
H2SO4+2HI
判断还原性由强到弱的顺序是
A.I->Fe2+>SO2 >Cl- B.SO2>Fe2+>I-> Cl-
C.SO2>I ->Fe2+> Cl- D.Fe2+>I->Cl->SO2
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.海水中存在大量镁单质
C.大力推广燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染
D.计算机芯片的材料是二氧化硅
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高二上学期期末化学试卷(解析版) 题型:选择题
已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸化学式 | HF | HClO | H2CO3 |
电离平衡常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是
A.常温下,同物质的量浓度NaClO与NaHCO3溶液,前者的pH较小
B.若某溶液中c(F—)=c(ClO—),往该溶液中滴入HCl,F-比ClO-更易结合H+
C.往饱和Na2CO3溶液中逐滴加入稀盐酸至过量,所得溶液中c(HCO3—)先增大后减小
D.同温下,等体积、等pH的HF和HClO分别与NaOH完全反应,消耗等量的NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高一上学期期末考试化学试卷(解析版) 题型:选择题
(9分)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
试剂 | 离子反应方程式 | |
①NaHCO3溶液(Na2CO3) | ||
②FeCl3溶液(FeCl2) | ||
③CO2(HCl) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期一模考试化学试卷(解析版) 题型:实验题
(13分)某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案,请并回答相应问题。

Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是_____________;加热A一段时间后,A、B中可观察到明显的现象,其中B中的现象__________,任写出一个A中发生反应的化学方程式________________________________________。
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是 。并且发现此时产生的气体具有可燃性,请用离子方程式表示产生此种气体的原因______________。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数
为 (写表达式)。
(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com