
(13分)某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案,请并回答相应问题。

Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是_____________;加热A一段时间后,A、B中可观察到明显的现象,其中B中的现象__________,任写出一个A中发生反应的化学方程式________________________________________。
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是 。并且发现此时产生的气体具有可燃性,请用离子方程式表示产生此种气体的原因______________。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数
为 (写表达式)。
(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。
(2)常温下,Fe被浓硫酸钝化,碳不与浓硫酸反应(2分); 品红溶液褪色;(1分)
2Fe+6H2SO4(浓)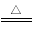 Fe2(SO4)3+3SO2↑+6H2O(2分)(或C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O(2分)(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O);
CO2↑+2SO2↑+2H2O);
(3)铁碳在溶液中形成原电池(2分);Fe+2H+==Fe2++H2↑(2分);(4)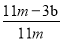 ×100%(2分);(5)SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O(其它合理的也对)。(2分)
×100%(2分);(5)SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O(其它合理的也对)。(2分)
【解析】
试题分析:(1)由于 常温下碳与浓硫酸不反应,Fe遇浓硫酸发生钝化,所以m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象。
(2)浓硫酸的还原产物是SO2,SO2均有漂白性,则B中的现象品红溶液褪色;浓硫酸具有强氧化性,铁、碳与浓硫酸在加热时反应的化学方程式分别为2Fe+6H2SO4 (浓) Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(3)由于在硫酸的作用下铁、碳在溶液中形成原电池,从而加快反应速率;随着反应的进行硫酸的浓度逐渐降低,稀硫酸与铁反应生成可燃性气体氢气,反应的离子方程式无Fe+2H+==Fe2++H2↑。
(4)待A中不再逸出气体时,停止加热,拆下装置E并称重,装置E增重b g。由于反应中产生的SO2被酸性高锰酸钾溶液氧化而吸收,则E中增加的质量就是反应中产生的CO2的质量,所以根据碳原子守恒可知铁碳合金中铁的质量分数为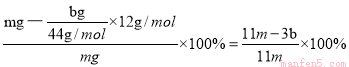 。
。
(4)由于空气中含有CO2和水蒸气,因此装置E可吸收空气中的CO2和水蒸气,导致E质量增重偏大,另外SO2也不一定能全部被品红、KMnO4吸收也导致E质量增重偏大,从而使测定结果偏低。
考点:考查物质含量测定实验方案设计与探究


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
科学家指出:多种海产品如虾、蟹、牡蛎等体内含有+5价的砷(As)元素,它对人体是无毒的,吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:“大量海鲜+大量维生素C = 砒霜(As2O3)”,这说明维生素C具有
A.氧化性 B.还原性 C.酸性 D.碱性
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质,按强电解质、弱电解质、非电解质的顺序排列的是
A.NaCl、BaSO4 、SO2
B.Cu、CH3COOH、酒精
C.氯化钠晶体、水、酒精
D.KNO3、NH3·H2O、CaCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于甲苯的实验中,能说明侧链对苯环有影响的是
A.甲苯硝化生成三硝基甲苯 B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯燃烧带有浓厚的黑烟 D.甲苯与氢气可以生加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质中,一定互为同系物的是
A.HCHO和CH3COOH B.CH3COOH和C3H6O2
C.C2H4O2 和C4H8O2 D.乙苯和异丙基苯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期一模考试化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,不正确的是

A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:填空题
(7分)环境中氮氧化物的合理控制和治理是减少雾霾天气、优化生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=== 4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) === 2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:_______________________;
(2)用活性炭还原法也可处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)
N2 (g)+CO2 (g)
某研究小组向一个容积(3L)恒定的真空密闭容器中加人0.3mol NO和足量的活性炭与催化剂(固体试样的体积忽略不计),在恒温(T1℃)条件下发生反应,经10min反应达到平衡,测得N2的物质的量为0.09mol。
①0min~10min内以v(NO)表示的平均化学反应速率为 。
②下列各项能判断该反应达到平衡状态的是 。
A.容器内压强保持不变
B.速率关系:2v(NO)(正) = v (N2)(逆)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
③在相同条件下,若在容器中放人生石灰,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邢台市高二上学期期末考试化学试卷(解析版) 题型:填空题
选考题[选修3:物质结构与性质]现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大,A元素的价电子构型为nsnnpn+1,C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6,E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,G元素与B元素位于同一主族,其外围电子排布是4s24p4,被科学家称为人体微量元素中的“防癌之王”。
(1)A元素的第一电离能________B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为________(用元素符号表示)。
(2)D元素原子的价电子排布式是________。
(3)C元素的电子排布图为________;E3+的离子符号为________。
(4)F元素符号为________,其基态原子的电子排布式为________。G元素的名称是________。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省静宁县高一上学期期末考试化学试卷(解析版) 题型:选择题
在下列反应类型中,一定属于非氧化还原反应的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com