
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 _________________________ 。
(2)表中能形成两性氢氧化物的元素是 __________ (用元素符号表示),写出该元素与⑨最高价氧化物的水化物反应的化学方程式 ________________________________ 。
(3)④元素与⑦元素形成化合物的电子式 _________________________ 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ___________(填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 ____________ 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
______________ | ________________ |
【答案】  Al 2Al+ 2KOH + 2H2O =2KAlO2+3H2↑
Al 2Al+ 2KOH + 2H2O =2KAlO2+3H2↑ ![]() HClO4 26 将少量氯水加入盛有溴化钠溶液的试管中,(振荡后,加入少量四氯化碳,)振荡 若加入氯水后溶液呈棕黄色,(加入少量四氯化碳后,四氯化碳层呈棕色,)证明单质氯比单质溴氧化性强
HClO4 26 将少量氯水加入盛有溴化钠溶液的试管中,(振荡后,加入少量四氯化碳,)振荡 若加入氯水后溶液呈棕黄色,(加入少量四氯化碳后,四氯化碳层呈棕色,)证明单质氯比单质溴氧化性强
【解析】由元素在元素周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)稀有气体Ar化学性质最不活泼,原子核外有18个电子,各层电子式为2、8、8,原子结构示意图为 ;(2)能形成两性氢氧化物的元素为Al,处于周期表中第三周期第ⅢA族;⑨最高价氧化物的水化物为KOH,二者反应生成偏铝酸钾与水,反应方程式为:2Al+ 2KOH + 2H2O =2KAlO2+3H2↑;(3)④元素与⑦元素形成化合物MgCl2,由镁离子与氯离子构成,用电子式表示
;(2)能形成两性氢氧化物的元素为Al,处于周期表中第三周期第ⅢA族;⑨最高价氧化物的水化物为KOH,二者反应生成偏铝酸钾与水,反应方程式为:2Al+ 2KOH + 2H2O =2KAlO2+3H2↑;(3)④元素与⑦元素形成化合物MgCl2,由镁离子与氯离子构成,用电子式表示![]() ;(4)最高价氧化物的水化物中酸性最强的是HClO4;(5)③元素与⑩元素两者核电荷数之差是35-9=26;(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,实验步骤:将少量氯水加入盛有溴化钠溶液的试管中,(振荡后,加入少量四氯化碳,)振荡;实验现象与结论:若加入氯水后溶液呈棕黄色,(加入少量四氯化碳后,四氯化碳层呈棕色,)证明单质氯比单质溴氧化性强。
;(4)最高价氧化物的水化物中酸性最强的是HClO4;(5)③元素与⑩元素两者核电荷数之差是35-9=26;(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,实验步骤:将少量氯水加入盛有溴化钠溶液的试管中,(振荡后,加入少量四氯化碳,)振荡;实验现象与结论:若加入氯水后溶液呈棕黄色,(加入少量四氯化碳后,四氯化碳层呈棕色,)证明单质氯比单质溴氧化性强。


科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,以致死亡。该外毒素为环状肽,结构式如图所示,请据图分析回答:

(1)该化合物中含有游离的氨基_____________个,羧基________________个。
(2)该化合物是由_____________个氨基酸组成的,区别这些氨基酸的种类是依靠其结构中的_____________。
(3)组成该化合物的氨基酸有___________种,其中有_____________个氨基酸的R基相同,这个R基是_______________。
(4)该化合物称为环状__________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A._________________,B.___________________。
(6)该化合物具有8个氮原子,其中_____________个位于肽键上,____________个位于R基上。
(7)该外毒素环肽在形成过程中失去了______________个水分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
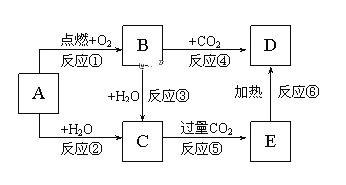
填写下列空白:
(1)写出化学式:A______________,D______________。
(2)以上反应中属于氧化还原反应的有______________(填序号)。
(3)反应③的化学方程式中:氧化剂是________还原剂是_________
(4)写出反应②的化学方程式:并用双线桥法标出电子转移方向和数目________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A. 标准状况下,1.12L 1H2和0.2g2H2均含有0.1NA个质子
B. 1mol Na2CO3晶体中含有的CO32-数目一定为NA
C. 常温常压下,92g NO2和N2O4的混合气体中含有的原子数为6NA
D. 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
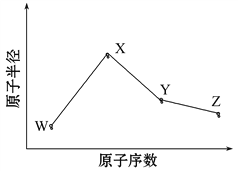
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。
(4)在25 ℃、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已准确称量过的氢氧化钠固体配制0.20 mol·L-1的氢氧化钠溶液250 mL,要用到的仪器是( )
①250 mL容量瓶 ②托盘天平 ③烧瓶 ④胶头滴管 ⑤烧杯 ⑥玻璃棒 ⑦试管 ⑧药匙
A. ①④⑤⑥ B. ①②④⑤
C. ①②④⑤⑥⑧ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 100mL MgCl2 和 AlCl3 混合溶液中,c(Cl-)=1.2mol/L,c(Mg2+)=0.3mol/L。欲使 Mg2+全部沉淀而分离出来,至少需 4 mol/L NaOH 溶液( )
A. 25mL B. 30mL C. 35mL D. 100mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族

D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com