
| A.氨水与亚硫酸溶液混合:NH3·H2O+H+=NH4++H2O |
| B.SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO |
C.铜与浓硫酸共热:Cu+4H++SO42- Cu2++SO2↑+2H2O Cu2++SO2↑+2H2O |
| D.把H2S通入CuSO4溶液中:H2S+Cu2+=CuS↓+2H+ |
科目:高中化学 来源:不详 题型:单选题
| 选项 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中投入铝片 | 2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-=Fe(OH3)↓ |
| C | 往NaHCO3溶液中滴入Ca(OH)2溶液 | 往NaHCO3溶液中滴入NaOH溶液 | OH-+HCO3-=CO32-+H2O |
| D | 往NaOH溶液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
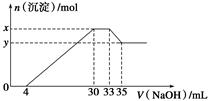
| A.x-y=0.01 mol |
| B.原溶液中c(Cl-)=0.75 mol·L-1 |
| C.原溶液的pH=1 |
| D.原溶液中n(Mg2+)∶n(Al3+)=5∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
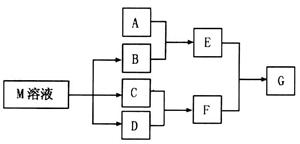
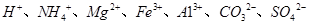 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。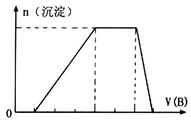
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+®2Mn2++10CO2↑+8H2O |
| B.在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-®NH3·H2O |
| C.VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O®5VO2++Mn2++2H+ |
| D.Fe2+离子被空气氧化:4Fe2++O2+2H2O®4Fe3++4OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

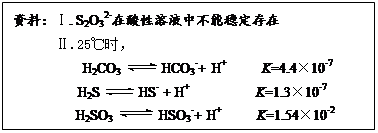
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C.有些化学反应既属于复分解反应又属于氧化还原反应 |
| D.铜片放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com