
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图2表示反应中的能量变化;图1表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图2表示反应中的能量变化;图1表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图2”中,曲线__(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H=_________。
(2)从反应开始到建立平衡,v(CO)=_______;达到平衡时,c(H2)=_____,该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_____________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡__________移动(填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为_____________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡__________移动(填“正向”、“逆向”或“不”)。
(3)恒容条件下,下列措施中能使n(CH3OH)/n(CO)增大的有___________.
a.升高温度 b.充入He气 c.再充入2molH2 d.使用催化剂.
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式________________。
【答案】b -91kJmol-1 0.075molL-1min-1 0.5molL-1 12 正向 c CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H= -281kJ/mol
【解析】
(1)根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
(2)根据v=△c/△t进行计算;利用各物质平衡的浓度来计算平衡时化学平衡常数;
(3)结合平衡移动的方向,分析n(CH3OH)/n(CO)如何变化;
(4)32g的CH3OH的物质的量为1mol,结合盖斯定律计算;
(1)由图可以知道,反应活化能b的较小,所以b使用了催化剂,该反应中反应物的总能量大于生成物的总能量,该反应为放热反应。由图可以知道,反应物为1mol CO 和2molH2,生成物为1mol CH3OH,△H=(419-510)kJ/mol=-91kJ/mol ,因此,本题正确答案是:b;-91kJmol-1 ;
(2)v(CO)=(1-0.25)mol/L÷10min=0.075 molL-1min-1;列出该反应的三段式
CO(g) + 2H2(g) CH3OH(g)
C0 1 mol/L 2 mol/L 0 mol/L
△C 0.75mol/L 1.5mol/L 0.75mol/L
C平 0.25mol/L 0.5mol/L 0.75mol/L
故达到平衡时,c(H2)= 0.5mol/L;
该反应的平衡常数K=![]() =12;达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,体积减小,压强增大,平衡向体积减小的方向移动,则平衡正向移动;
=12;达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,体积减小,压强增大,平衡向体积减小的方向移动,则平衡正向移动;
(3)a.升高温度,平衡逆向移动,n(CH3OH)/n(CO)减小;
b.恒容条件下,充入He气,n(CH3OH)/n(CO)不变;
c.恒容条件下,再充入2molH2,n(CH3OH)/n(CO)增大;
d.使用催化剂,n(CH3OH)/n(CO)不变;综上,本题选c;
(4) CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-193kJ/mol ①, H2O(l)= H2O(g);ΔH=+44 kJ/mol ②,①-②×2得,CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H= -281kJ/mol;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L。下列判断错误的是
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L。下列判断错误的是
A. x=1
B. B的转化率为80%
C. 2min内A的平均反应速率为0.3 mol·L-1·min-1
D. 若混合气体的密度不变,也不能说明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是_。反应过程__(填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_(填序号)。
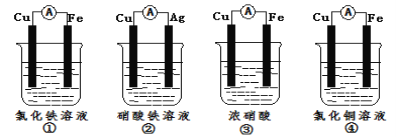
(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中_(填A或B)处电极入口通甲烷,当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为__mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为__。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温2L密闭容器中通入气体X并发生反应:2X(g) ![]() Y(g) ΔH<0,X的
Y(g) ΔH<0,X的
物质的量n(x)随时间t变化的曲线如下图所示(图中两曲线分别代表有无催化剂的情形)

(1)下列措施不能提高反应速率的是____。
A 升高温度 B 加入适量X C 增大压强 D 及时分离出Y
(2)反应从开始到a点的平均反应速率可表示为v(Y)=_____,X的转化率为____;
(3)____线表示使用催化剂的情形(填“实”或“虚”);
(4)图中c点对应的速率关系是![]() (正)____
(正)____![]() (逆) (填“大于”“小于”或“等于”);
(逆) (填“大于”“小于”或“等于”);
(5)反应进行到a点时放出的热量 _______反应进行到b点时放出的热量(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用平衡移动原理解释的是
A. 卤化银沉淀的转化

B. 配制FeCl3溶液

C. 淀粉在不同条件下水解

D. 探究石灰石与稀盐酸在密闭环境下的反应

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中用400mL 0.075molL-1的KMnO4溶液处理2gCu2S和CuS的混合物,发生如下反应: ① 8MnO4- + 5Cu2S + 44H+ = 10Cu2+ + 5SO2↑+ 8Mn2+ + 22H2O② 6MnO4- + 5CuS + 28H+ = 5Cu2+ + 5SO2↑+ 6Mn2+ + 14H2O,反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1molL-1的(NH4)2Fe(SO4)2溶液完全反应。已知该反应的化学方程式如下:2KMnO4+10(NH4)2Fe(SO4)2+8H2SO4=K2SO4+2MnSO4+10(NH4)2SO4+5Fe2(SO4)3+8H2O
(1)反应①的氧化剂为____;还原剂为_______;氧化产物为___________。
(2)用双线桥法标出反应②的电子转移情况____ 6MnO4- + 5CuS + 28H+ = 5Cu2+ + 6Mn2++ 5SO2↑ + 14H2O
(3)反应②中每转移3mol电子,可生成标准状况下气体的体积为_________L。
(4)KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为 ______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250 ℃,使其充分反应,当排出O2和H2O(g)的物质的量之比为1∶1 时,a∶b为
A.1∶1 B.1∶2 C.2∶3 D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2NO2(g)![]() N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是
N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是

图a 图b
A. 图a 中,A1→A2变化的原因一定是充入了NO2
B. 图b中,E点对应状态中,v(正)> v(逆)
C. 图b中,E→A所需的时间为x,D→C所需时间为y,则x < y
D. 依据图b分析可知,该化学反应△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com