
【题目】【四川省泸州市2017届高三三诊考试理综】
以某种软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)为主要原料生产KMnO4的一种流程图如下:

已知:Mn(OH)2极易被空气氧化;Fe(OH)3、Al(OH)3的溶度积常数依次为4.0×10-38、1.3×10-33。
(1)滤渣A的化学式是_________;溶液B中的主要阴离子有______________。
(2)为避免引入杂质,②步调节pH加入的物质是____________;调节pH除杂过程中,后析出的
沉淀是________________。
(3)浓硫酸与MnO2反应也能生成Mn2+,其化学方程式是___________________。
(4)K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,则③步原料应保证_______________。
④步溶解水应煮沸的目的是_____________________。
(5)⑤步的阳极电极反应式是____________;该法电解时要产生污染,其原因是________________。
【答案】SiO2 SO42-、Cl- MnCO3或MnO Al(OH)3 2H2SO4(浓)+2MnO2=2MnSO4+ 2H2O+ O2↑ KOH过量 排除溶解的CO2 MnO42- -e-=MnO4- 电解时会生成氯气
【解析】(1) 软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)中加入稀硫酸,只有二氧化硅不溶,滤渣A的主要成分为二氧化硅;滤液中加入次氯酸钠,将亚铁离子氧化为铁离子,本身被含有为氯离子,溶液B中的主要阴离子有SO42-、Cl-,故答案为:SO42-、Cl-;
(2)溶液B中含有的阳离子为Mn2+、Fe3+、Al3+,②步的目的是调节pH时Fe3+、Al3+沉淀除去,加入的物质可以是MnCO3或MnO,故答案为:MnCO3或MnO ; Al(OH)3、Fe(OH)3;
(3)浓硫酸与MnO2反应也能生成Mn2+,反应的化学方程式为2H2SO4(浓)+2MnO2=2MnSO4+ 2H2O+ O2 ↑,故答案为:2H2SO4(浓)+2MnO2=2MnSO4+ 2H2O+ O2 ↑;
(4) K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,为了防止歧化反应的发生,③步原料应保证KOH过量,④步溶解水应煮沸可以排除溶解的CO2,故答案为:KOH过量;排除溶解的CO2;
(5)⑤步中电解K2MnO4溶液生成KMnO4,阳极发生氧化反应,电极反应式为MnO42- -e-=MnO4-,K2MnO4溶液中含有氯化钾,电解时氯离子放电生成氯气,会污染空气,故答案为:MnO42- -e-=MnO4- ;电解时会生成氯气。


科目:高中化学 来源: 题型:
【题目】氢气在工业合成中广范应用。
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol
请写出由CO2和H2制取甲醇的热化学方程式______________。
(2)己知合成氨的反应为:N2+3H2![]() 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是________(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=_____________。
③b容器中M点,v(正)________v(逆)(填“大于”、“小于”或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为________;标准状况下,当阴极收集到11.2LN2时,理论上消耗NH3的体积为_____________。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)____ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3H2O+H2CO3的平衡常数K=_______。
NH3H2O+H2CO3的平衡常数K=_______。
(已知常温下NH3H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,属于同分异构体的是
A.O2和O3
B.CH2=CHCH2CH3和CH3CH=CHCH3
C. CH3CH2OH和CH3OCH3
D. CH3CH2CH3和CH3(CH2)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A. 用结晶的方法分离汽油和水
B. 用过滤的方法除去氯化钠溶液中的泥沙
C. 用重结晶的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾
D. 蒸馏法分离乙酸(沸点118)和乙酸乙酯(沸点77.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016上海卷】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
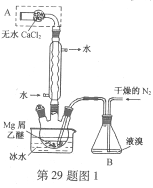
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
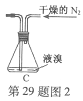
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;
②2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
现以A为主要原料合成乙酸乙酯,其合成路线如下图所示:

回答下列问题:
(1)写出C的结构简式____________。
(2)B、D分子中的官能团名称分别是________、________。
(3)写出A→B的反应类型:__________________。
(4)1 mol A与氯气发生完全加成反应,所得产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是____________ mol。
(5)实验室利用上述原理制取CH3COOCH2CH3,可用下图装置:
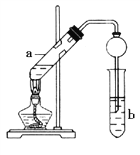
①a试管中的主要化学反应的方程式为_______________________________。
②球形干燥管的作用_______________________、________________________。
③试管b中盛放的是_________________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com