
【题目】氢气在工业合成中广范应用。
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol
请写出由CO2和H2制取甲醇的热化学方程式______________。
(2)己知合成氨的反应为:N2+3H2![]() 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是________(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=_____________。
③b容器中M点,v(正)________v(逆)(填“大于”、“小于”或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为________;标准状况下,当阴极收集到11.2LN2时,理论上消耗NH3的体积为_____________。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)____ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3H2O+H2CO3的平衡常数K=_______。
NH3H2O+H2CO3的平衡常数K=_______。
(已知常温下NH3H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
【答案】 CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1 c 800 小于 2NO3-+6e-+4H2O=N2+8OH- 22.4L > 1.25×10-3
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1 c 800 小于 2NO3-+6e-+4H2O=N2+8OH- 22.4L > 1.25×10-3
【解析】(1)已知:① CO(g) + 2H2(g)![]() CH3OH(g) ΔH1= -90.8kJ/mol,
CH3OH(g) ΔH1= -90.8kJ/mol,
②CO2(g)+H2(g)![]() CO(g)+ H2O (g)ΔH2=+41.3kJ/mol,根据盖斯定律,①+②可得CO2(g) +3H2(g)
CO(g)+ H2O (g)ΔH2=+41.3kJ/mol,根据盖斯定律,①+②可得CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) ,则 △H=( -90.8kJ/mol)+(+41.3kJ/mol)=-49.5 kJ·mol-1 ,故CO2和H2制取甲醇的热化学方程式为CO2(g) +3H2(g)
CH3OH(g) +H2O(g) ,则 △H=( -90.8kJ/mol)+(+41.3kJ/mol)=-49.5 kJ·mol-1 ,故CO2和H2制取甲醇的热化学方程式为CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1 ;
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1 ;
(2)①N2+3H22NH3△H<0,而恒容绝热容器中进行,所以体系温度最高,反应速率最快,达平衡的时间最短,而由图可知消耗时间最短的是c,故选:c;
②平衡常数是温度的函数,温度不变K不变,而曲线a和曲线b的温度相同,
N2 + 3H2 2NH3,
初起:1mol2.8mol 0
变化:0.8mol2.4mol 1.6mol
平衡:0.2mol0.4mol 1.6mol
所以Kb=![]() =800=Ka;
=800=Ka;
③b容器中M点,最终达平衡状态,所以氮气的转化率减小,平衡逆向移动,则v(正)小于v(逆);
(3)阴极发生还原反应,电极反应式为2NO2-+6e-+4H2O=N2↑+8OH-;阴极收集到1l.2LN2时,即物质的量为0.5mol,转移电子数的物质的量为:3mol,所以消耗氨气的物质的量为:1mol,则标况下的体积为22.4L;
(4)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,所以碳酸氢根的水解程度更大,溶液中c(NH4+)>c(HCO3-) ;反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=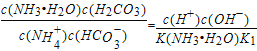 =
=![]() =1.25×10-3。
=1.25×10-3。


科目:高中化学 来源: 题型:
【题目】(1)互为同分异构体的四种有机物A、B、C、D,它们的相对分子质量为74,完全燃烧只生成CO2和H2O,经分析其含氧元素的质量分数为43.3%,则这些有机物的分子式为___________,
(2)已知A、B、C、D分子结构中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 |
A | 中和反应 | —— | 溶 解 | 产生氢气 |
B | —— | 有银镜 | 加热后有红色沉淀 | 产生氢气 |
C | 水解反应 | 有银镜 | 加热后有红色沉淀 | —— |
D | 水解反应 | —— | —— | —— |
则A、B、C、D的结构简式分别为
A____________ B____________ C____________ D____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列盐:①FeCl3 ②CH3COONa ③NaCl,其水溶液的pH由大到小排列正确的是
A. ①>③>②B. ②>③>①C. ③>②>①D. ①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 利用该技术可捕捉大气中的CO2
C. 每得到1mol草酸铝,电路中转移3mol电子
D. 正极的电极反应为:C2O42--2e-=2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中
A.一定有SO42- B.可能有SO42- 或Ag+
C.一定无Ag+ D.还可能有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一个原电池.
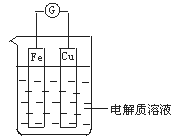
当电解质溶液为硝酸银溶液时:
①Fe电极是__________(填“正”或“负”)极,其电极反应为________________________,该反应是__________(填“氧化”或“还原”)反应;
②Cu电极是__________电极,其电极反应为______________________,该反应是__________反应(填“氧化”或“还原”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是

A. a点时:c(CH3COOH) >c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
B. b点时:c(Na+)=c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+) > c(CH3COO-)>c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取a g CO在足量的O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体增加的质量为
A.小于a g B.等于a g C.大于a g D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【四川省泸州市2017届高三三诊考试理综】
以某种软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)为主要原料生产KMnO4的一种流程图如下:

已知:Mn(OH)2极易被空气氧化;Fe(OH)3、Al(OH)3的溶度积常数依次为4.0×10-38、1.3×10-33。
(1)滤渣A的化学式是_________;溶液B中的主要阴离子有______________。
(2)为避免引入杂质,②步调节pH加入的物质是____________;调节pH除杂过程中,后析出的
沉淀是________________。
(3)浓硫酸与MnO2反应也能生成Mn2+,其化学方程式是___________________。
(4)K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,则③步原料应保证_______________。
④步溶解水应煮沸的目的是_____________________。
(5)⑤步的阳极电极反应式是____________;该法电解时要产生污染,其原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com