
【题目】【2016上海卷】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
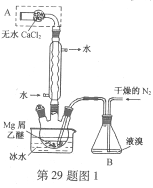
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
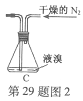
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
【答案】(1)干燥管防止镁屑与氧气反应,生成的MgO阻碍Mg与Br2的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患
(3)镁屑
(4)BD
(5)①从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次
②97.5%
【解析】
试题分析:(1)仪器A为干燥管。本实验要用镁屑和液溴反应生成无水溴化镁,所以装置中不能有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气。(2)将装置B改为装置C,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患。而装置B是利用干燥的氮气将溴蒸气代入三颈烧瓶中,反应可以控制,防止太快。(3)步骤3过滤出去的是不溶于水的镁屑。(4)A、95%的乙醇中含有水,溴化镁有强烈的吸水性,错误;B、加入苯的目的是除去乙醚和溴,洗涤晶体用0℃的苯,可以减少产品的溶解,正确;C、加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,错误;D、该步骤是为了除去乙醚和溴,故正确。故选BD。(5)①滴定前润洗滴定管是需要从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次。②根据方程式分析,溴化镁的物质的量为0.0500×0.02650=0.001325mol,则溴化镁的质量为0.001325×184=0.2438g,溴化镁的产品的纯度=0.2438/0.2500=97.5%。


科目:高中化学 来源: 题型:
【题目】某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中
A.一定有SO42- B.可能有SO42- 或Ag+
C.一定无Ag+ D.还可能有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
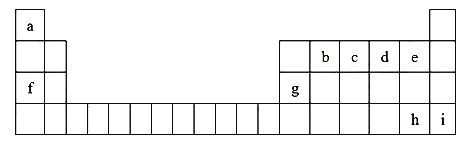
【题目】如图是元素周期表的一部分,表中所列字母分别代表一种元素
回答下列问题:
(1)h元素的名称是______,九种元素中金属性最强的是_______ (填元素符号)。
(2)f的最高价氧化物对应的水化物的化学式____(填化学式)。
(3)b、c、d、e的原子半径依次________(填增大或减小)。
(4)e、h元素的氢化物中,热稳定性大的是__(填氢化物的化学式)。
(5)化合物f2d2与化合物 a2d 反应的离子方程式__________。
(6)工业上冶炼g元素的单质的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途错误的是
A. 硅是制造太阳能电池的常用材料 B. 二氧化硅是制造光导纤维的材料
C. 水玻璃可用作木材防火剂 D. 硅是制取水泥的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【四川省泸州市2017届高三三诊考试理综】
以某种软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)为主要原料生产KMnO4的一种流程图如下:

已知:Mn(OH)2极易被空气氧化;Fe(OH)3、Al(OH)3的溶度积常数依次为4.0×10-38、1.3×10-33。
(1)滤渣A的化学式是_________;溶液B中的主要阴离子有______________。
(2)为避免引入杂质,②步调节pH加入的物质是____________;调节pH除杂过程中,后析出的
沉淀是________________。
(3)浓硫酸与MnO2反应也能生成Mn2+,其化学方程式是___________________。
(4)K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,则③步原料应保证_______________。
④步溶解水应煮沸的目的是_____________________。
(5)⑤步的阳极电极反应式是____________;该法电解时要产生污染,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下n为气体。m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A. 原子半径:Z>Y
B. 化合物p中只存在离子键
C. 图示转化关系涉及的反应均为氧化还原反应
D. 最简单气态氢化物的稳定性:W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1) B元素符号为____,A与C以原子个数比为1:1形成的化合物的电子式为___,用电子式表示C与E形成化合物的过程____, D形成的简单离子的结构示意图为____。
(2) F的氢化物是由____(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式____。
(3) 非金属性D____E(填大于或小于),请从原子结构的角度解释原因:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com