
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下: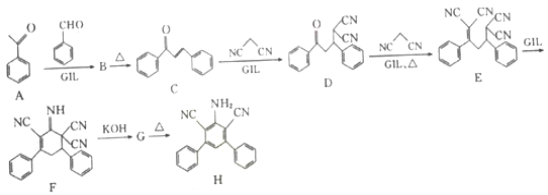
(1) C中含有的官能团名称为______________。
(2) C—D的反应类型为______________。
(3)已知:G和H的分子式相同,F→G和B→C反应类型均为消去反应,那么G的结构简式为______________。
(4)写出满足下列条件的B的一种同分异构体X的结构简式: ______________。
①1 mol X完全水解消耗2 mol NaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3:2:2:1。
X在酸性条件下发生水解反应的产物名称为_________。
(5)以乙醇为原料利用GIL合成聚酯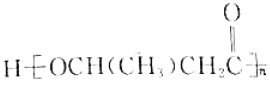 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
【答案】羰基和碳碳双键 加成反应 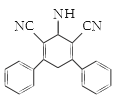
 对甲基苯酚和对甲基苯甲酸
对甲基苯酚和对甲基苯甲酸 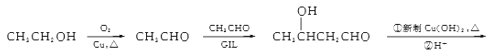
![]()
【解析】
(1)根据C的结构简式,C中含有的官能团是羰基和碳碳双键;
(2)对比C和D的结构简式,C→D的反应类型为加成反应;
(3)F→G发生消去反应,对比F和G的结构简式,则G的结构简式为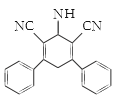 ;
;
(4)B→C发生消去反应,以及对比A和C结构简式,推出B的结构简式为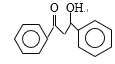 ,1mol X完全水解消耗2mol NaOH,根据B的结构简式,X中应含有“
,1mol X完全水解消耗2mol NaOH,根据B的结构简式,X中应含有“ ”,水解酸化后得到两种产物,它们的核磁共振氢谱均有4个峰,说明含有四种不同环境的氢原子,峰高比为3:2:2:1,这是不同氢原子的个数比,即X的结构简式为
”,水解酸化后得到两种产物,它们的核磁共振氢谱均有4个峰,说明含有四种不同环境的氢原子,峰高比为3:2:2:1,这是不同氢原子的个数比,即X的结构简式为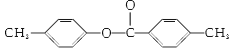 ,水解后得到对甲基苯酚和对甲基苯甲酸;
,水解后得到对甲基苯酚和对甲基苯甲酸;
(5)该聚酯的单体为HOCH(CH3)CH2COOH,根据流程,A生成B碳原子数增加,让乙醇氧化成乙醛,两个乙醛分子生成CH3CH(OH)CH2CHO,将其氧化成CH3CH(OH)CH2COOH,再发生缩聚反应,其路线为
![]()
。


科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NaHCO3能与NaOH反应,可用作食品疏松剂
B.N2的化学性质稳定,可用作粮食保护气
C.Fe2(SO4)3易溶于水,可用作净水剂
D.Al(OH)3受热易分解,可用于制胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是
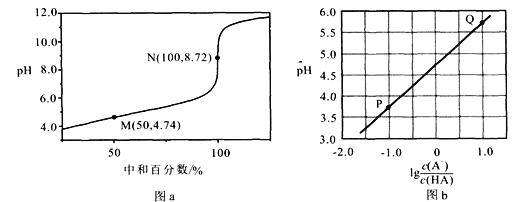
A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)相同质量的CO和CO2,它们所含的原子数之比为___________,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____________。
(2)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(3)标准状况下有①0.112 L水 ②0.5NA个HCl分子 ③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne 所含原子个数从大到小的顺序为___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3) 的原理如图:
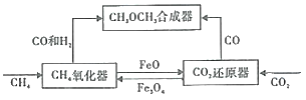
(1)二甲酸的合成反应:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);△H1
①已知CO、CH3OCH3与H2的燃烧热(△H)分别为 a kJ/mol、b kJ/mol、c kJ/mol(a、b、c均小于0),则△H1 ____kJ/moL。
②该反应选用(CuO/ZnO/Al2O)复合催化剂,该催化剂能_____(填标号)。
A.提高反应速率 B.促进平衡正向移动 C.改变反应的焓变 D.降低反应的活化能
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图。
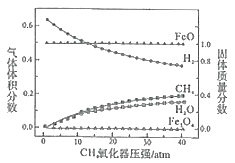
①随着压强的增大,反应i的平衡常数K值________(填“增大”、“减小”或“不变”)。
②结合图像,分析H2O的体积分数变化的原因________(用化学方程式表示)。
(3)将一定量的FeO 和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)。保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2______0(填“>”或“<”)。
②由上表可知,若在150℃时进行上述转化,理论转化率α(FeO)为100%。在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.CO2的物质的量不变
B.体系的压强不变
C.气体的平均摩尔质量不变
D.CO的生成速率和消耗速率相等且不等于零
③根据化学反应原理,分析CO2还原器温度设置在170℃的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4.和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
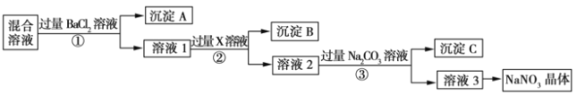
请回答下列问题:
(1)产生沉淀A的离子反应方程式是:________________________;
(2)试剂X是:____________________________________;
(3)上述实验流程中①②③步骤中均要用到的主要玻璃仪器有____________;
(4)上述实验流程中加入过量Na2CO3溶液产生的沉淀C是:________________________。
(5)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的____________ (填化学式),并写出离子反应方程式:_______________________________________________。
(6)溶液3到硝酸钠晶体需要的操作步骤是:________________________洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药物“6-Azulenol”的结构简式如图所示,下列有关叙述正确的是( )

A.分子式为C12H18O2
B.分子中含有两种官能团,能发生加成、氧化、酯化反应
C.能使溴水、酸性高锰酸钾溶液褪色,且褪色原理相同
D.lmol该物质与足量的Na反应可产生22.4LH2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________。
(3)E的最高价氧化物分子的空间构型是__________,是____分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________。(a)中E原子的配位数为____。
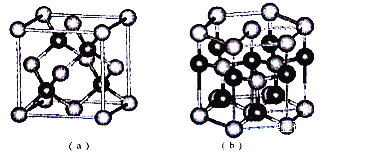
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是合成磷酸氨喹的中间体,一种合成路线如下:

回到下列问题:
(1)A中的官能团名称是______________。
(2)C的化学名称为____________。
(3)⑦的反应类型是_____________。
(4)已知③为取代反应,另一生成物为乙醇,E的结构简式为__________。
(5)写出G到H的反应方程式______________。
(6) H在一定条件下可以转化为(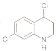 ),请写出任意一 种同时符合下列条件M的同分异构体_____________________。
),请写出任意一 种同时符合下列条件M的同分异构体_____________________。
①含苯环且苯环上有3个取代基
②含有NH2,能发生加聚反应
③核磁共振氢谱图为6组峰,峰面积比为1:1:1:2:2:2
(7)设计以对羟基苄氯(![]() )、CH3CH2OH为主要原料制备(
)、CH3CH2OH为主要原料制备(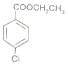 )的合成路线(无机试剂任选)。_________。
)的合成路线(无机试剂任选)。_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com