
【题目】现有NaCl、Na2SO4.和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
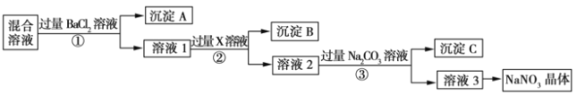
请回答下列问题:
(1)产生沉淀A的离子反应方程式是:________________________;
(2)试剂X是:____________________________________;
(3)上述实验流程中①②③步骤中均要用到的主要玻璃仪器有____________;
(4)上述实验流程中加入过量Na2CO3溶液产生的沉淀C是:________________________。
(5)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的____________ (填化学式),并写出离子反应方程式:_______________________________________________。
(6)溶液3到硝酸钠晶体需要的操作步骤是:________________________洗涤,干燥。
【答案】Ba2++SO42-=BaSO4↓ AgNO3 烧杯、玻璃棒和三角漏斗 Ag2CO3和BaCO3 HNO3 CO32-+H+=H2O+CO2↑ 蒸发浓缩、冷却结晶、再过滤
【解析】
由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为BaSO4,溶液1中含氯化钠、硝酸钠、氯化钡,②中加AgNO3后氯离子转化沉淀,沉淀B为AgCl,溶液2中含硝酸钠、硝酸银、硝酸钡,③中钡离子,银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钠和碳酸钠,转化中试剂过量保证离子完全转化为沉淀,以此来解答。
由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为BaSO4,溶液1中含氯化钠、硝酸钠、氯化钡,②中加AgNO3后氯离子转化沉淀,沉淀B为AgCl,溶液2中含硝酸钠、硝酸银、硝酸钡,③中钡离子,银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钠和碳酸钠;
(1) 沉淀A为BaSO4,产生沉淀A的离子反应方程式是Ba2++SO42-=BaSO4↓;
(2) 由上述分析可知,X为AgNO3;
(3)流程中①②③步均生成沉淀,需要进行过滤操作,均要用到的主要玻璃仪器有烧杯、玻璃棒和三角漏斗;
(4) 加入过量的Na2CO3的目的是使溶液中的Ag+、Ba2+完全沉淀,则产生的沉淀C是Ag2CO3和BaCO3;
(5) 流程③滴加过量碳酸钠溶液,则过滤后的溶液3中肯定含有Na2CO3,可加适量的稀HNO3除去,发生反应的离子方程式为CO32-+H+=H2O+CO2↑;
(6)由于硝酸钠受热易分解,所以溶液3中滴加适量的稀硝酸后,经蒸发浓缩、冷却结晶、再过滤、洗涤、干燥即可得到纯净的硝酸钠。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成氢气和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式:
A.________;B.________;C.________。
(2)写出化学方程式:
①C与水蒸气反应______________________________________________________;
②A与水反应_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:
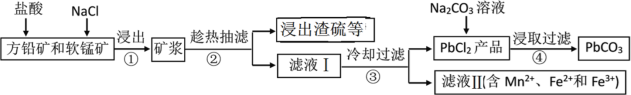
已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
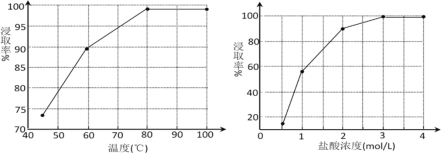
(2)步骤①中MnO2的作用是________,根据下图分析过程①的最佳反应条件是_________。
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Ⅱ先酸化,然后加入MnO2,反应的离子方程式为________;若反应后![]() ,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________
,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________![]() 时表示Fe3+已沉淀完全]。
时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______,铬元素在周期表中______区。
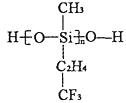
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为_______杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______填元素符号
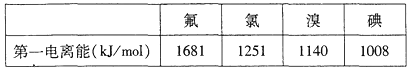
②根据价层电子对互斥理论,预测ClO3-的空间构型为______形,写出一个ClO3-的等电子体的化学符号______。
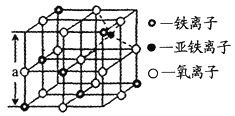
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?_____(填“是”或“否”);该立方体是不是Fe3O4的晶胞?______(填“是”或“否”);立方体中铁离子处于氧离子围成的_______(填空间结构)空隙;根据下图计算Fe3O4晶体的密度为________g/cm3。(图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下: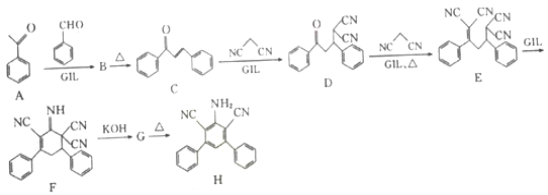
(1) C中含有的官能团名称为______________。
(2) C—D的反应类型为______________。
(3)已知:G和H的分子式相同,F→G和B→C反应类型均为消去反应,那么G的结构简式为______________。
(4)写出满足下列条件的B的一种同分异构体X的结构简式: ______________。
①1 mol X完全水解消耗2 mol NaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3:2:2:1。
X在酸性条件下发生水解反应的产物名称为_________。
(5)以乙醇为原料利用GIL合成聚酯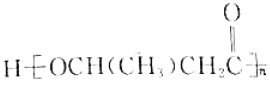 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖冰”是科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。用“暖冰”做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色。则下列说法不正确的是( )
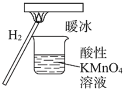
A.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧的产物中可能含有一定量的H2O2
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
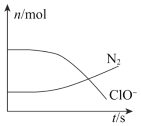
A.该反应中Cl-为氧化产物
B.NH4+是还原剂,ClO-是氧化剂
C.消耗1mol还原剂,转移6mol电子
D.反应后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A. 11.2 L 甲烷和乙烯的混合物中含氢原子数目等于2NA
B. 含NA个 CO32-的 Na2CO3溶液中,Na+数目大于2NA
C. 密闭容器中,2 molSO2和足量 O2充分反应,产物的分子数小于2NA
D. 4.0 g CO2气体中含电子数目等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹K,使两烧瓶内的气体充分混合后,容器内的压强最小的是
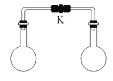
A.H2S和 SO2B.NH3和HCl
C.H2和Cl2D.NO和 O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com