
����˵����ȷ����
| A��0.1 mol/L��Һ�е�(NH4)2SO4����Һ�е�c(NH4��)��c(SO42��) |
| B����ͬ�¶��£�0.6 mol/L��ˮ��Һ��0.3 mol/l��ˮ��Һ��c(OH��)֮����2��1 |
| C����0.1 mol/LNaNO3��Һ�еμ�����ʹ��ҺpH=5����ʱ���Һ�е�c(Na��)��c(NO3��) |
| D�����������Һ�м����������ᣬʹ���Һ��pH=7,��ʱ���Һ��c(Na��)��c(CH3COO��) |
C
�������������A(NH4)2SO4="2" NH4++SO42-����������Һ��NH4+�ᷢ��ˮ�ⷴӦ����ˮ��ij̶��Ǻ������ܵ���˵c(SO42��)��c(NH4��)������B.�ڰ�ˮ�д��ڵ���ƽ��:NH3�� H2O  NH4��+ OH��.������ߵĵ���̶���ͬ�������ְ�ˮ�е�c(OH��)֮����2��1��������Һ��Ũ��Խ�� ������̶�ԽС����������������Һ��c(OH��)֮��С��2��1����������Na+ֻ��NaNO3�����������NO3������NaNO3��HNO3��ͬ������������Ի��Һ�е�c(Na��)��c(NO3��)����ȷ��D�����Һ��pH=7,��C(H+)=C(OH-)��������Һ�ʵ����Կ�֪C(H+)+c(Na��)=c(CH3COO��) +C(OH-)���ɵ�c(Na��)=c(CH3COO��)������
NH4��+ OH��.������ߵĵ���̶���ͬ�������ְ�ˮ�е�c(OH��)֮����2��1��������Һ��Ũ��Խ�� ������̶�ԽС����������������Һ��c(OH��)֮��С��2��1����������Na+ֻ��NaNO3�����������NO3������NaNO3��HNO3��ͬ������������Ի��Һ�е�c(Na��)��c(NO3��)����ȷ��D�����Һ��pH=7,��C(H+)=C(OH-)��������Һ�ʵ����Կ�֪C(H+)+c(Na��)=c(CH3COO��) +C(OH-)���ɵ�c(Na��)=c(CH3COO��)������
���㣺������Һ������Ũ�ȵĴ�С�Ƚϵ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��0.1 mol��L-1������Һ����μ��백ˮ������ʱ����Һ�ĵ���������������Ӧ�ı仯�������ǿ������백ˮ�����(V)�仯�����߹�ϵ����ͼ�е�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪25��ʱ�й�����ĵ���ƽ�ⳣ����
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.77��l0�C5 | 4.9��l0�C10 | Ki1=4.3��l0�C7 Ki2=5.6��l0�C11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�0.01 mol/L ��Ԫ��H2A��Һ��pH= 3������˵����ȷ����
A����Na2A��NaHA������Һ�У�����������ͬ
B��NaHA��Һ��pHһ������7
C����NaHA��Һ��һ����c(OH-)+ c(A2-) = c(H2A)+ c(H+)
D�������ʵ����ʵ�����ȵ�Na2A��NaHA������Һ�У��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���20.00mL 0.1000 mol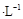 (NH4)2 SO4��Һ����μ���0.2000 mol
(NH4)2 SO4��Һ����μ���0.2000 mol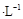 NaOHʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ�������ǻӷ�����
NaOHʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ�������ǻӷ�����
����˵����ȷ����
| A����a��ʾ��Һ�У�c(NH4+)��c(SO42-)��c(H+)��c(OH��) |
| B����b��ʾ��Һ�У�c(NH4+)��c(Na��)��c(H��)��c(OH��) |
| C����c��ʾ��Һ�У�c(SO42)+ c(H+)�� c(NH3��H2O )+ c(OH��) |
| D����d��ʾ��Һ�У�c(SO42)��c(NH3��H2O )��c(OH��)��c(NH4+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£����и����ֵΪ1��2���ǣ� ��
| A��0.1 mol��L��0.2 mol��L������Һ��c (H+)֮�� |
| B��0.1 mol/L NaHCO3��Һ��c(HCO3��)��c(Na+)֮�� |
| C��pH=10��Ba(OH)2��Һ�백ˮ�����ʵ����ʵ���Ũ��֮�� |
| D��pH=3�������������Һ��c(SO42��)��c(CH3COO��)֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������(SrSO4)��ˮ�еij����ܽ�ƽ���������£�����˵����ȷ����
| A���¶�һ��ʱ��Ksp(SrSO4)��c(SO42��)���������С |
| B��������ͬ�¶��У�363KʱKsp(SrSO4)��� |
| C��283Kʱ��ͼ��a���Ӧ����Һ�Dz�������Һ |
| D��283K�µ�SrSO4������Һ���µ�363K���Ϊ��������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ˮ�����ص��������������ԣ������йص�˵������������� �ڰ�ˮ���� ��ǡ����ȫ��Ӧ ��c (NH4+) = c(Cl��) ��c (NH4+) �� c(Cl��) ��ȷ����
| A���ڢ� | B���ۢ� | C���ڢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
HA��HB���������Һ�ֱ��ˮϡ��ʱ��pH�仯�ļ�ͼ��ͼ��ʾ����������������ȷ����
| A��HA��һ��ǿ�� |
| B��x�㣬[A��]��[B��] |
| C��HB��һ������ |
| D��ԭ��Һ��HA�����ʵ���Ũ��ΪHB��10�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com