
| A�� | ��֪��H2��g��+$\frac{1}{2}$O2��g���TH2O��l������H=-285.8 kJ•mol-1����H2��ȼ����Ϊ-285.8 kJ•mol-1 | |
| B�� | ��֪��S��g��+O2��g���TSO2��g����H1=-Q1��S��s��+O2��g���TSO2��g����H2=-Q2����Q1��Q2 | |
| C�� | ��֪��$\frac{1}{2}$H2SO4��Ũ��+NaOH��aq���T$\frac{1}{2}$Na2SO4��aq��+H2O��l����H1�� CH3COOH��aq��+NH3•H2O��aq���TCH3COONH4��aq��+H2O��l����H2������|��H1|��|��H2| | |
| D�� | ��֪��Fe2O3��s��+3C��ʯī���T2Fe��s��+3CO��g����H=+489.0 kJ•mol-1 CO��g��+$\frac{1}{2}$O2��g���TCO2��g����H=-283.0 kJ•mol-1 C��ʯī��+O2��g���TCO2��g����H=-393.5 kJ•mol-1 ��4Fe��s��+3O2��g���T2Fe2O3��s����H=-1641.0 kJ•mol-1 |
���� A��ȼ������1mol��ȼ����ȫȼ�������ȶ�������ų���������
B��S��g��ת��ΪS��s����Ҫ���ȣ��ʱ�Ϊ��ֵ�Ƚϴ�С��
C��Ũ������ˮ���ȣ�CH3COOH��Ӧ���̵������ȣ�
D�������Ȼ�ѧ����ʽ��˹���ɼ�������жϣ�
��� �⣺A��ȼ������1mol��ȼ����ȫȼ�������ȶ�������ų���������H2��ȼ����Ӧ��Ϊ285.8 kJ•mol-1����A����
B��S��g��ת��ΪS��s����Ҫ���ȣ��ʱ�Ϊ��ֵ�Ƚϴ�С������Q1��Q2����B����
C��Ũ������ˮ���ȣ�CH3COOH��Ӧ���̵������ȣ���|��H1|��|��H2|����C����
D�������Ȼ�ѧ����ʽ��˹���ɼ��㣬
��Fe2O3��s��+3C��ʯī���T2Fe��s��+3CO��g����H=+489.0 kJ•mol-1
��CO��g��+$\frac{1}{2}$O2��g���TCO2��g����H=-283.0 kJ•mol-1
��C��ʯī��+O2��g���TCO2��g����H=-393.5 kJ•mol-1
��˹���ɼ��㣨��-�ڣ���6-�١�2�õ��Ȼ�ѧ����ʽΪ��4Fe��s��+3O2��g���T2Fe2O3��s����H=-1641.0 kJ•mol-1��
��ѡD��
���� ���⿼����ȼ���ȡ��к��ȸ����ʵ������Ӧ�ã��Ȼ�ѧ����ʽ��д���ʱ��С�Ƚϣ���Ҫ�Ǹ�˹���ɵļ���Ӧ�ã���Ŀ�Ѷ��еȣ�


 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 22.4 L NH3�к���ԭ����Ϊ NA | |
| B�� | 1 mol Na2O2��ˮ��ȫ��Ӧʱת�Ƶĵ�����ΪNA | |
| C�� | 100 mL 2.0 mol•L-1 NH4HCO3��Һ��NH4+��Ϊ0.2NA | |
| D�� | 1 mol O2��2 mol SO2���ܱ������г�ַ�Ӧ��ķ���������2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
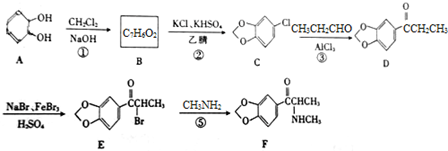
 ��
�� ����ṹ��ʽ����
����ṹ��ʽ���� ���ĺϳ�·�ߣ�
���ĺϳ�·�ߣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
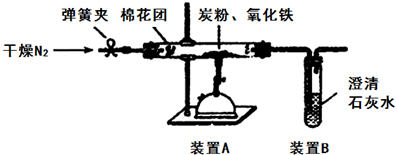
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
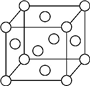 A��B��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ��������������AԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��ʣ�B��Aͬ���ڣ�����������δ�ɶԵ��ӣ�Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ/mol��I2=1 817kJ/mol��I3=2 745kJ/mol��I4=11 575kJ/mol�����³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���ʣ�Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34����ش��������⣺
A��B��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ��������������AԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��ʣ�B��Aͬ���ڣ�����������δ�ɶԵ��ӣ�Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ/mol��I2=1 817kJ/mol��I3=2 745kJ/mol��I4=11 575kJ/mol�����³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���ʣ�Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪2H2��g��+O2��g���T2H2O��g����H=-483.6 kJ/mol����������ȼ����Ϊ241.8 kJ | |
| B�� | ��C��ʯī��s���TC�����ʯ��s����H=+11.9 kJ•mol-1��֪�����ʯ��ʯī�ȶ� | |
| C�� | ͬ��ͬѹ�£�H2��g��+Cl2��g���T2HCl��g���ڹ��պ͵�ȼ�����ġ�H��ͬ | |
| D�� | �κ�һ����ѧ�仯�������������ı仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | �� | �� | �� |
| ��Һ | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | ��Һ������Һ�ڵ������� |
| pH | 3.1 | 8.1 | δ�ⶨ |
| A�� | ����c��K+����c��HC2O4-����c��C2O42-����c��H+����c��OH-�� | |
| B�� | ����c��K+����c��C2O42-����c��HC2O4-����c��OH-����c��H+�� | |
| C�� | ����c��K+����c��HC2O4-����c��C2O42-����c��OH-����c��H+�� | |
| D�� | ����2c��OH-��+c��C2O42-��=3c��H2C2O4��+c��HC2O4-��+2c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 11.1 mol•L-1KCIO3��Һ�к��е���������ĿΪNA | |
| B�� | ��״���£�22.4L H2O���еķ�����ĿΪNA | |
| C�� | 16g O2��16gO3���е���ԭ����Ŀ��� | |
| D�� | 1 mol Zn��ΪZn2+ʱʧȥ�ĵ�����ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 7�� | B�� | 6�� | C�� | 5�� | D�� | 4�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com