
| 编号 | ① | ② | ③ |
| 溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
| pH | 3.1 | 8.1 | 未测定 |
| A. | ①中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| B. | ②中:c(K+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) | |
| C. | ③中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | ③中:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+) |
分析 A.HC2O4-与水都会电离出氢离子;
B.C2O42-水解生成HC2O4-与OH-,水电离出氢氧根离子;
C.HC2O4-与C2O42-的混合溶液中HC2O4-的电离程度大于C2O42-水解程度;
D.根据物料守恒和电荷守恒.
解答 解:A.HC2O4-与水都会电离出氢离子,所以溶液中c(H+)>c(C2O42-),则溶液中离子浓度大小的关系为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故A错误;
B.C2O42-水解生成HC2O4-与OH-,水电离出氢氧根离子,则c(OH-)>c(HC2O4-),所以溶液中离子浓度大小的关系为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),故B错误;
C.HC2O4-与C2O42-的混合溶液中HC2O4-的电离程度大于C2O42-水解程度,溶液显酸性,则溶液中离子浓度大小的关系为:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-),故C错误;
D.0.01mol/L KHC2O4与0.01mol/L K2C2O4等体积混合,溶液中的物料守恒为:2c(K+)=3c(C2O42-)+3c(H2C2O4)+3c(HC2O4-),溶液中的电荷守恒为:c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),联立两个关系式消去钾离子的浓度可得:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+),故D正确.
故选D.
点评 本题考查离子浓度大小比较,题目涉及弱电解质的电离和盐的水解、物料守恒即电荷守恒的应用,题目难度中等,试题培养了学生的分析能力及灵活应用能力.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:多选题
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1; CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、SO32-、S2-、K+ | B. | Fe3+、Cl-、S2-、Ba2+ | ||
| C. | Cu2+、Cl-、S2-、K+ | D. | Na+、K+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
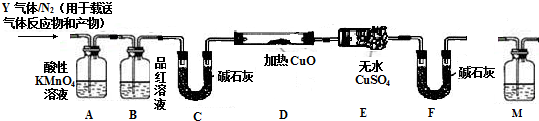
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
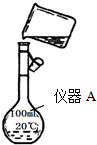 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com