
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
分析 (1)①氧化性Fe3+>Br2时,Br2不能将Fe2+氧化为Fe3+;
②氧化性Fe3+<Br2时,Br2能将Fe2+氧化为Fe3+;
(2)证明乙同学的观点是否正确,可检验是否生成了Fe3+,所用试剂为KSCN溶液,也可检验Br2是否已反应掉,所用试剂为CCl4;
(3)溴单质氧化性较强,能将亚铁离子氧化为Fe3+;
(4)①还原性Fe2+>Br-,若在溴化亚铁溶液中通入氯气,首先氧化还原性强的离子;
②$\frac{1}{2}$的Br-被氧化时Fe2+已全部反应,产物为FeCl3、Br2、FeBr3,且产物中Br2和FeBr3为3:2的关系,据此可得化学方程式为:6FeBr2+6Cl2═4FeCl3+3Br2+2FeBr3,根据方程式计算FeBr2的物质的量,进而计算其物质的量浓度.
解答 解:(1)①氧化性Fe3+>Br2时,反应2Fe2++Br2═2Fe3++2Br-不能发生,导致溶液呈黄色的微粒仅有Br2,
故答案为:Br2;
②氧化性Fe3+<Br2时,反应2Fe2++Br2═2Fe3++2Br-能够发生,导致溶液呈黄色的微粒仅有Fe3+,
故答案为:Fe3+;
(2)证明乙同学的观点是否正确,可检验是否生成了Fe3+,所用试剂为KSCN溶液,预期现象为溶液变成血红色,也可检验Br2是否已反应掉,所用试剂为CCl4,预期现象为CCl4层呈无色,
故答案为:
| 选用试剂 | 实验现象 | |
| 方案1 | b | CCl4层呈无色 |
| 方案2 | d | 溶液变红色 |
点评 本题考查物质性质的探究与实验方案设计,根据物质的性质设计实验方法,熟练掌握元素化合物性质,(4)中利用总反应方程式解答,可以避免离子方程式的繁琐.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
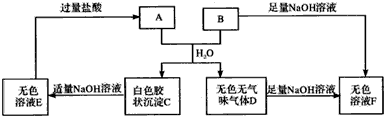
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
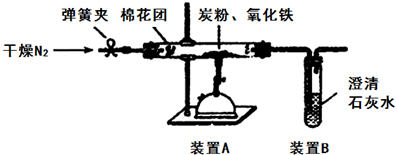
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 | |
| D. | 任何一个化学变化都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| 溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
| pH | 3.1 | 8.1 | 未测定 |
| A. | ①中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| B. | ②中:c(K+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) | |
| C. | ③中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | ③中:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 紫色的石蕊试液中通入CO2后变色 | B. | SO2漂白草编制品 | ||
| C. | 木炭使红棕色的NO2气体褪色 | D. | 淀粉遇碘变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.1 mol•L-1KCIO3溶液中含有的氯离子数目为NA | |
| B. | 标准状况下,22.4L H2O含有的分子数目为NA | |
| C. | 16g O2与16gO3含有的氧原子数目相等 | |
| D. | 1 mol Zn变为Zn2+时失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
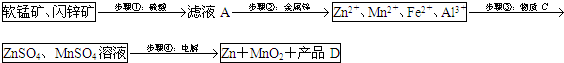
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com