
| A. | 11.1 mol•L-1KCIO3溶液中含有的氯离子数目为NA | |
| B. | 标准状况下,22.4L H2O含有的分子数目为NA | |
| C. | 16g O2与16gO3含有的氧原子数目相等 | |
| D. | 1 mol Zn变为Zn2+时失去的电子数目为NA |
分析 A.KClO3是氯酸根离子和钾离子构成,溶液中无氯离子;
B.标准状况下水不是气体,不能用标准状况气体摩尔体积计算;
C.依据氧元素守恒计算分析判断;
D.锌原子最外层电子数为2,1 mol Zn变为Zn2+时失去的电子数目为2个;
解答 解:A.KClO3是氯酸根离子和钾离子构成,溶液中无氯离子,故A错误;
B.标准状况下水不是气体,不能用标准状况气体摩尔体积计算,22.4L H2O含有的分子数目不是NA,故B错误;
C.依据氧元素守恒计算分析判断,16g O2与16gO3含有的氧原子物质的量相同,所以氧原子数目相等,故C正确;
D.锌原子最外层电子数为2,1 mol Zn变为Zn2+时失去的电子数目为2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析判断,主要是物质的量和微粒数的计算应用,注意气体摩尔体积的条件分析,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1; CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、SO32-、S2-、K+ | B. | Fe3+、Cl-、S2-、Ba2+ | ||
| C. | Cu2+、Cl-、S2-、K+ | D. | Na+、K+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D | 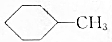 的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
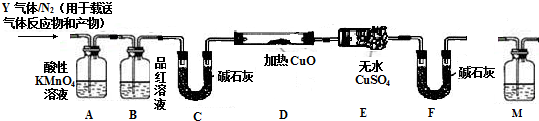
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4 能与水缓慢反应生成Fe(OH)3 和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 太阳能、风能是可再生能源,应大力推广太阳能、风能的使用 | |
| D. | 新型能源生物柴油和矿物油的主要化学成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2═Na2O2 | |
| B. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com