
【题目】计算
(1)24.5 g硫酸的物质的量是________mol,1.5 mol碳酸钠的质量是______ g。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为10.8 g。则混合气体中CO的物质的量是________mol。
(3)用36.5%的浓盐酸(密度为1.25 g·cm-3)在容量瓶中配制480 mL1mol·L-1的稀盐酸。经计算需要__________mL浓盐酸。
(4) 将15.6 g过氧化钠与足量二氧化碳反应时,反应中转移_________mol电子。
(5)将钠、镁、铝各0.3mo1分别放入100mL1mol·L-1的盐酸中,同温同压下产生的气体体积比是____________。
(6)将20.8gCu、Fe合金与足量的稀硝酸反应后,收集到标准状况下NO气体6.72L,向反应后溶液中加入足量的NaOH溶液,生成的沉淀的质量是_________g。原来合金中含Cu______mol,Fe______mol。
【答案】0.25 159 0.15 40 0.2 3:1:1 36.1 0.15 0.2
【解析】
(1)根据m=nM解答;
(2)根据V=nVm结合质量列方程解答;
(3)根据容量瓶的规格结合稀释过程中溶质的物质的量不变解答;
(4)根据反应的方程式结合氧元素的化合价变化解答;
(5)钠和稀盐酸、水都反应,根据Na计算生成氢气物质的量;Mg、Al不与水反应,根据镁和铝分别与稀盐酸反应的方程式判断出过量问题,根据不过量的物质计算氢气的物质的量,相同条件下气体体积之比等于物质的量之比;
(6)Cu、Fe在反应中失去电子,最终生成氢氧化铁、氢氧化铜,则可知失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,结合守恒法分析解答。
(1)24.5 g硫酸的物质的量是24.5g÷98g/mol=0.25mol,1.5 mol碳酸钠的质量是1.5mol×106g/mol=159g;
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,物质的量是6.72L÷22.4L/mol=0.3mol,质量为10.8 g,设混合气体中CO和CO2的物质的量分别是xmol、ymol,则x+y=0.3、28x+44y=10.8,解得x=y=0.15,即混合气体中CO的物质的量是0.15mol;
(3)根据![]() 可知36.5%的浓盐酸(密度为1.25 g·cm-3)的物质的量浓度是
可知36.5%的浓盐酸(密度为1.25 g·cm-3)的物质的量浓度是![]() =12.5mol/L。在容量瓶中配制480 mL1mol·L-1的稀盐酸,需要500mL容量瓶,则需要浓盐酸的体积为
=12.5mol/L。在容量瓶中配制480 mL1mol·L-1的稀盐酸,需要500mL容量瓶,则需要浓盐酸的体积为![]() =40mL;
=40mL;
(4)15.6 g过氧化钠的物质的量是15.6g÷78g/mol=0.2mol,与足量二氧化碳反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,反应中过氧化钠中氧元素化合价从-1价部分升高到0价,部分降低到-2价,过氧化钠既是氧化剂也是还原剂,则0.2mol过氧化钠转移0.2mol电子
(5)钠和稀盐酸、水都反应,根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量为0.15mol;Mg、Al不与水反应,镁和铝分别与稀盐酸反应的方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,因此二者与酸反应生成氢气的量相等,由氢原子守恒可知生成氢气的物质的量为0.05mol,所以同温同压下产生的气体的物质的量之比为0.15mol:0.05mol:0.05mol=3:1:1,
(6)Cu、Fe在反应中失去电子,最终生成氢氧化铁、氢氧化铜,由此可知Cu、Fe在反应中失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,根据HNO3+3e-→NO可知生成6.72LNO转移的电子为![]() =0.9mol,所以反应后生成沉淀的质量为20.8g+0.9mol×17g/mol=36.1g;设合金中铜和铁的物质的量分别是amol、bmol,则2a+3b=0.9、64a+56b=20.8,解得a=0.15、b=0.2,即原来合金中含Cu0.15mol,Fe 0.2mol。
=0.9mol,所以反应后生成沉淀的质量为20.8g+0.9mol×17g/mol=36.1g;设合金中铜和铁的物质的量分别是amol、bmol,则2a+3b=0.9、64a+56b=20.8,解得a=0.15、b=0.2,即原来合金中含Cu0.15mol,Fe 0.2mol。


科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为____,C原子的杂化形式为______。
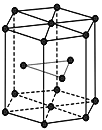
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子在强酸或强碱溶液中均能大量共存且溶液无色的是( )
A.H+、Na+、MnO4-、SO42-B.Na+、CO32-、A13+、C1
C.K+、Na+、Cl、SO42-D.K+、C1、Ba2+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出方程式
(1)写出铝与氢氧化钠溶液反应的离子方程式_________________________________。
(2)过氧化钠与水反应的离子方程式__________________________________。
(3)工业上制取漂白粉的化学方程式为___________________________________。
(4)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边振荡,未得到白色沉淀的原因是发生了_______反应(写出反应的化学方程式)。
(5)氨的催化氧化反应的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存且为无色透明溶液的是( )
A.K+ Cl- MnO4- SO42-B.Na+ CO32- NO3- SO42-
C.Na+ NO3- SO42- HCO3-D.Mg2+ SO42- S2- Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)
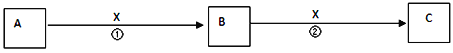
(1)若X是氧气,则A不可能是________________。
A.CB.SiC.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为____________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则B的化学式为________。
(4)若X为盐酸,A、B、C均含碳元素,A的焰色反应呈黄色,则反应①的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学研究中常用的方法.下列分类方法中,正确的是
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.NH4Cl组成中不含金属离子,不属于盐
C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
D.依据组成元素的种类,将纯净物分为单质和化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com