
����Ŀ���Ȼ����dz�����ˮ�����������÷���м���Ʊ���ˮ�Ȼ�����ʵ�����Ʊ�װ�ú�ҵ�Ʊ�����ͼ���£�
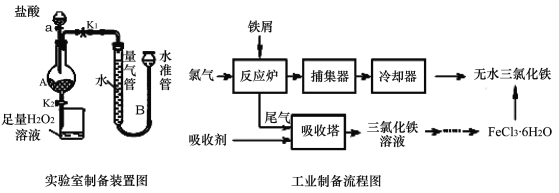
��֪����1����ˮFeCl3�۵�Ϊ555 K���е�Ϊ588 K��
��2������м�е����ʲ������ᷴӦ
��3����ͬ�¶�����ˮ���Ȼ�����ˮ�е��ܽ�����£�
�¶�/�� | 0 | 20 | 80 | 100 |
�ܽ��(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
ʵ�����Ʊ������������£�
�������ɼ�K1���رջ���K2��������a�������μ����ᡣ
������ ʱ���رյ��ɼ�K1�����ɼ�K2����A����Һ��ȫ�����ձ���رջ���a��
�������ձ�����Һ����һϵ�в�����õ�FeCl3��6H2O���塣��ش�
��1���ձ���������H2O2��Һ�������� ��
��2��Ϊ�˲ⶨ����м���������������������������������������� ��
��3����FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ����� �� �����ˡ�ϴ�ӡ����
��4����д���������з�Ӧ�����ӷ���ʽ�� ��
��5���������¶ȳ���673 Kʱ��������Է�������Ϊ325�������Ȼ�������ʵķ���ʽΪ ��
��6��FeCl3����������ͨ�����õ������ⶨ����ȡm g��ˮ�Ȼ�����Ʒ������ϡ���ᣬ���Ƴ�100mL��Һ��ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���뼸�ε�����Һ������c molL-1Na2S2O3��Һ�ζ�������VmL����֪��I2+2S2O32-�T2I-+S4O62-������Ʒ���Ȼ������������� ��
���𰸡���1������������ȫ������������������
��2��װ��A�в��������ݻ������ܺ�ˮ��Һ�治�ٸı䣨����������Ҳ���֣�
��3�����������������ȣ�Ũ������ȴ�ᾧ
��4��2Fe2++Cl2 = 2Fe3+ + 2Cl��
��5��Fe2Cl6��6��![]()
��������
�����������1������ʵ��װ�úͲ��������֪��ʵ�����Ʊ���ˮFeCl3���������������ᷴӦ����FeCl2��Ȼ���FeCl2������FeCl3�����Ƶ�FeCl36H2O���壬���ѽᾧˮ�Ƶ���ˮFeCl3���ձ���������H2O2��Һ����������������������ȫ�����������������ӣ��ʴ�Ϊ������������ȫ�����������������ӣ�
��2���������ᷴӦ��ȫʱ�����ٲ�������������װ��A�в��������ݻ������ܺ�ˮ�ܵ�Һ�治�ٱ仯����ʱ���ɽ�A��FeCl2��Һ�����ձ��н����������ʴ�Ϊ��װ��A�в��������ݻ������ܺ�ˮ��Һ�治�䣨����������Ҳ���֣���
��3����FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ�����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ʴ�Ϊ���������Ũ������ȴ�ᾧ��
��4���ӹ�ҵ�Ʊ�����ͼ������֪����Ӧ¯�н��еķ�Ӧ�� 2Fe+3Cl2=2FeCl3����ˣ������������е�β����û�вμӷ�Ӧ���������������������������ռ����գ���Ӧ������2FeCl3��Һ���������ռ�Ӧ��2FeCl2��Һ����Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl-���ʴ�Ϊ��2Fe2++Cl2=2Fe3++2Cl-��
��5���������ռ�������̬FeCl3��FeCl3����Է���������162.5������Է�������Ϊ325�������Ȼ�������Ƴ������¶ȳ���673Kʱ����������̬FeCl3���Ծۺ�����˫����Fe2Cl6���ʴ�Ϊ��Fe2Cl6��
��6���ɷ�Ӧ��2Fe3++2I -=2Fe2++I2�� I2+2S2O32-�T2I-+S4O62-���ɵù�ϵʽ��
2Fe3+-I2-2S2O32-
2 2
n cV��10-3
���n��Fe3+��=cV��10-3mol������Ʒ���Ȼ�������������Ϊ������Fe3+��=cV��10-3mol��10��162.5g/mol��100%=![]() %���ʴ�Ϊ��
%���ʴ�Ϊ��![]() %��
%��


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ֻ��������ϵ�ͬ���칹�壬��ͬ���칹���е�ijһ�ֵ�һ�ȴ���ֻ��һ�֣��������������ǣ��ٷ��Ӿ���7��̼ԭ�ӵķ������ڷ����о���4��̼ԭ�ӵ������۷����о���12����ԭ�ӵ������ܷ����о���8��̼ԭ�ӵ�������������
A���٢� B���ڢ� C���ۢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�����CO2��CO�Թ�����̼�������Ҫ���塣
��1������H2 ��CO��һ�������·������·�Ӧ��CO��g��+2H2��g��![]() CH3OH��g�������ȷ�Ӧ�����Դ˷�Ӧ���������о����ں��£����Ϊ2L���ܱ������зֱ����1.2mol CO��1mol H2��10min��ﵽƽ�⣬��ú���0.4mol CH3OH��g����
CH3OH��g�������ȷ�Ӧ�����Դ˷�Ӧ���������о����ں��£����Ϊ2L���ܱ������зֱ����1.2mol CO��1mol H2��10min��ﵽƽ�⣬��ú���0.4mol CH3OH��g����
��10min��ﵽƽ��ʱCO��Ũ��Ϊ ��
��10min����H2��ʾ��ƽ����Ӧ����Ϊ ��
����Ҫ�ӿ�CH3OH���������ʣ��ɲ�ȡ�Ĵ�ʩ�� ����һ�ֺ����Ĵ�ʩ��
��2������H2 ��CO2��һ�������¿��Ժϳ���ϩ��6H2��2CO2![]() CH2��CH2��4H2O
CH2��CH2��4H2O
����֪��4.4gCO2��H2��ȫת��ΪCH2��CH2��ˮ����̬�����ų�6.39kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
����ͬ�¶ȶ�CO2��ת���ʼ������Ĵ�Ч�ʵ�Ӱ����ͼ����ʾ��

�����й�˵������ȷ���� �����������
A����ͬ�����·�Ӧ��N����������
B���¶���Լ250��ʱ�������Ĵ�Ч�����
C����ͬ�����£���ϩ�IJ���M���N��
�������ܱ������г��������Ϊ 3��1�� H2��CO2����ͼ����M��ʱ������CH2��CH2���������Ϊ ����������λ��Ч������
��3������һ�ּ���ˮ��Һ������ʣ�CO2�����ԭΪ��ϩ����ͼ����ʾ���������ϲ�����ϩ�ĵ缫��Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
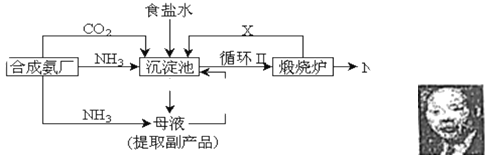
��1��������������ķ����� ������Ʒ��һ����;Ϊ ��
��2���������з����Ļ�ѧ��Ӧ����ʽ�� ��
��3��д������������X���ʵķ���ʽ ��
��4��ʹԭ���Ȼ��Ƶ������ʴ�70%��ߵ�90%���ϣ���Ҫ������� �������������еı�ţ���ѭ�����ӳ�������ȡ�������IJ����� ��
��5��Ϊ����Ч�س�ȥ�����е�Ca2+��Mg2+��SO42���������Լ���˳��Ϊ ��ѡ��a��b��c����
a���ȼ�NaOH�����Na2CO3���ټ�BaCl2
b���ȼ�NaOH�����BaCl2���ټ�Na2CO3
c���ȼ�BaCl2�����NaOH���ټ�Na2CO3
��6��Ϊ�����Ʒ̼�������Ƿ����Ȼ��ƣ��䷽���� ��
��7����ĸҺ��ͨ����������ϸСʳ�ο�������ȴ��������Ʒ��ͨ������������ ��
A������NH4����Ũ�ȣ�ʹNH4Cl���������
B��ʹNaHCO3���������
C��ʹNaHCO3ת��ΪNa2CO3�����������NH4Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ���ɵ����������к��������γɺϽ�һ�������������Ͻ�����������NaOH��Һ�У���ȫ��Ӧ�����6.72 L����״���������壻��ͬ�������������Ͻ���ȫ���������������У��ڱ�״���²���11.2 L���塣��úϽ��������������ʵ���֮��Ϊ
A��1�U1 B��2�U5 C��3�U2 D��3�U5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ǣ� ��
A�����ö����ЧӦ����������Һ�ͽ���
B�����ȱ���FeCl3��Һ����ȡFe��OH��3����
C��������ɫ��Ӧ���Լ���NaCl��KNO3��Na2SO4
D����Ca��OH��2��Һ��������Na2CO3��NaHCO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ������������ǣ� ��
A. CH3CH2CH3
B. CH3CH2CH2��
C. ��CH2CH2CH2��
D. ��CH3��2CH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��F����Ԫ�ص�ԭ��������������FΪ����Ԫ���⣬�������־��Ƕ�����Ԫ�ء���֪����F�ĵ���Ϊ����������Ľ���֮һ��ԭ���������2�����ӣ���Eԭ�ӵļ۵����Ų�Ϊmsnmpn��Bԭ�ӵĺ���L�������Ϊ��������A��Dԭ��p����ĵ������ֱ�Ϊ2��4.��ش��������⣺
��1��F���ȶ���̬���ӵĵ����Ų�ʽ��__________________________��A��B��D��E����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ________________(��Ԫ�ط��ű�ʾ)��
��2������B�ļ��⻯�������ԭ�ӵĹ���ӻ�������________________�����ӵ����幹��Ϊ________________�����⻯��������D�ļ��⻯�����Ҫԭ����________________��
��3��Dԭ�ӷֱ���A��Bԭ���γɵĵ����У����ļ��Խ�ǿ��________________(�þ���Ļ�ѧ����ʾ)��
��4����ͼ��ʾ�ľ�������AD��Ԫ����ɵģ������йظþ����˵������ȷ����_______��

a���þ���Ļ�ѧʽΪAD
b���þ�����A��Dԭ�Ӽ��γɵ���˫��
c���þ����۵���ܱ�SiO2�����
d���þ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2����ѧ�뼼����
Ԫ��������������������Ӧ�ù㷺�Ľ���Ԫ�ء�
��1����������һ�����²��ϣ�Ҳ�ǹ�ҵ����ȡ����ԭ�ϡ�����������Ҫ�ɷ���Al2O3����SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ�����������ͼ��ʾ��
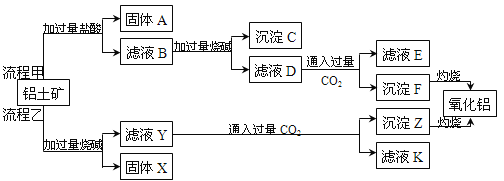
��A����Ҫ�ɷ��� ���ѧʽ����ͬ��������X����Ҫ�ɷ��� ��
����ҺE�����ʵ���Ҫ�ɷ��� ��д�������ʵ�һ����;�� ��
������ҺD��ͨ�����CO2ʱ��Ӧ�����ӷ���ʽΪ ��
��2����ҵ�ϵ��������ұ����ʱ�������ʯ��Na3AlF6���������� ���ڵ��صĹ��������У���Ҫ���ϲ����������ϣ�ʯī����ԭ���� ��
��3��һ������Ч��ˮ��PAFC�����ۺ��Ȼ�����[AlFe(OH)nCl6��n]m��n<5��m<10���ɹ㷺Ӧ�����ճ�������ˮ��ҵ��ˮ�Ĵ����������й�PAFC��˵����ȷ���� ������ţ���
A��PAFC����Ԫ����+2��
B��PAFC���ھ�ˮʱ��������ͬ���ʵ������Ȼ������Ȼ�����pH�ı�С
C��PAFC�ɿ���һ���������Ȼ������Ȼ���ˮ����м����
D��PAFC��ǿ���Ի�ǿ������Һ�ж����ȶ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com