
【题目】【化学——选修2:化学与技术】
元素铝是在生产、生活中应用广泛的金属元素。
(1)氧化铝是一种耐高温材料,也是工业上制取铝的原料。从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下图所示:
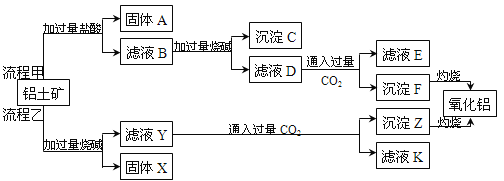
体A的主要成分是 (填化学式,下同),固体X的主要成分是 。
②滤液E中溶质的主要成分是 ,写出该溶质的一种用途: 。
③在滤液D中通入过量CO2时反应的离子方程式为 。
(2)工业上电解氧化铝冶炼铝时加入冰晶石(Na3AlF6)的作用是 。在电解池的工作过程中,需要不断补充阳极材料(石墨),原因是 。
(3)一种新型高效净水剂PAFC——聚合氯化铁铝[AlFe(OH)nCl6-n]m(n<5,m<10)可广泛应用于日常生活用水和工业污水的处理。下列有关PAFC的说法正确的是 (填序号)。
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同物质的量的氯化铝和氯化铁的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性或强碱性溶液中都能稳定存在
【答案】(1)①SiO2;Fe2O3、MgO;
②NaHCO3;制纯碱(或作发酵粉等合理答案);
③AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)作助熔剂(或降低氧化铝的熔点);电解时生成的O2在高温时会和石墨电极发生反应;
(3)BC。
【解析】
试题分析:(1)①铝土矿含有的成分中SiO2不与盐酸反应,所以固体A的主要成分是SiO2;Fe2O3、MgO不与NaOH溶液反应,所以固体X的主要成分是Fe2O3、MgO。②滤液D中主要含有NaAlO2,向其中通入过量CO2后,反应生成Al(OH)3和NaHCO3,Al(OH)3难溶于水,NaHCO3溶于水,所以滤液E中溶质的主要成分是NaHCO3,其可用来制纯碱或作发酵粉;③NaAlO2溶液通入过量CO2的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)氧化铝的熔点很高,电解时加入冰晶石的作用是作助熔剂,降低氧化铝的熔点。电解时生成的O2在高温时会和石墨电极发生反应,消耗石墨电极,故石墨电极需要不断补充。
(3)A.根据化合物中元素正负化合价代数和等于0,PAFC中铁元素显+3价,错误。氯化铝和氯化铁都能水解,溶液显酸性,PAFC是碱式盐,Fe3+、Al3+水解产生的H+可被溶液中的OH中和,对水的pH改变小,正确。C.PAFC可看作一定比例的氯化铁和氯化铝水解的中间产物,正确。D.PAFC既能与H+反应,又能与OH反应,在强酸或强碱性溶液中都不能稳定存在,错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
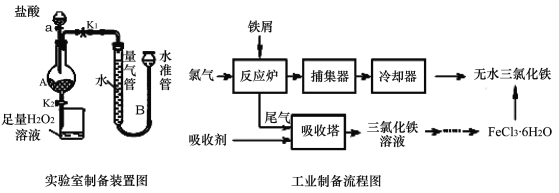
已知:(1)无水FeCl3熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入 后、 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c molL-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。样品中氯化铁的质量分数 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中伴随着能量变化。
(1)下列反应中,属于吸热反应的是 (填序号)。
A.燃烧CO
B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
C.铝和稀盐酸反应
D.NaOH溶液和稀盐酸反应
(2)按下图所示装置进行实验。
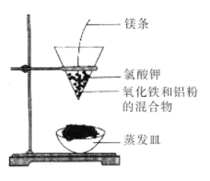
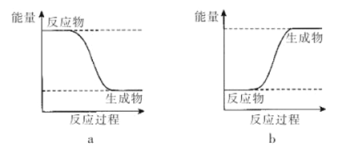
【实验现象】反应剧烈,火星四射,漏斗下方有红热熔融物流出。由此判断该反应是 (填“吸热”或“放热”)反应,其反应的化学方程式是 ,其能量变化可用下图中的 (填“a”或“b”)表示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是维持人体生命活动所必需的营养物质,下列叙述正确的是
A.糖类、油脂、蛋白质都能够发生水解
B.糖类、油脂、蛋白质都是高分子化合物
C.单糖和双糖都能与新制Cu(OH)2 悬浊液反应产生砖红色沉淀
D.蛋白质在浓硝酸作用下能发生颜色反应,可用来鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知火箭燃料二甲基肼(CH3—NH—NH—CH3)的燃烧热为-6 000 kJ·mol-1,则
30 g二甲基肼完全燃烧放出的热量为( )
A.1 500 kJ B.3 000 Kj C.6 000 kJ D.12 000 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用固体硫酸亚铁制取颜料铁红,反应原理是:2FeSO4![]() Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
A. (I)中会生成 BaSO3、BaSO4两种沉淀
B. 可将(I)中的 BaCl2溶液改为 Ba(NO3)2溶液
C. (II)所盛 x 应为品红溶液
D. (III)的作用是检验生成的SO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C是三种常见的固体化合物。焰色反应均显黄色。其中A与C按任意比例混合,溶于足量的水中,得到的溶质只含有一种,并有无色无味的气体D放出。另A、B、C、D之间有如图所示的转化关系(部分物质未写出):
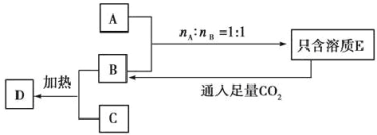
(1)写出下列物质的化学式:
A________、B________、C________。
(2)写出A、B按物质的量之比1:1在密闭容器中加热发生反应的化学方程式:______________________。
(3)写出饱和的E溶液与足量CO2反应的离子方程式:________。
(4)有关铝、铁、铜的说法正确的是________ (填代号)。
a.铝属于主族元素,铁和铜属于过渡元素
b.工业上利用电解法冶炼铝、铁、铜
c.铝、铁、铜对应的氧化物均为碱性氧化物
d.铝、铁、铜常温下都不溶于浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试推测第 82 号元素 X 的单质及其化合物不可能具有的性质:
A. X 的氧化物的水化物可能有两种
B. 单质是能导电的固体
C. 单质不能与氢气直接化合
D. X 是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400mL某溶液中含有0.1mol Fe2+、0.2mol Fe3+加入0.2mol铁粉,待Fe3+反应完全后,溶液中Fe2+的物质的量浓度为(假设反应前后溶液体积不变)( )
A.0.4mol·L-1 B.0.6mol·L-1 C.0.8mol·L-1 D.1.0mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com