
| A、加催化剂同时升高温度 |
| B、降低温度同时增大压强 |
| C、增大压强同时充入CO |
| D、加催化剂同时增大压强 |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、加水稀释至溶液体积为200mL,醋酸溶液的pH变为4 |
| B、温度都升高20°C后,两溶液的pH不再相等 |
| C、加水稀释至溶液体积为200mL后,两种溶液中c(OH-)都减小 |
| D、加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.5 |
| B、等于0.5 |
| C、大于1且小于2 |
| D、大于0.5且小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
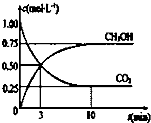 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.| c(CH3OH) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、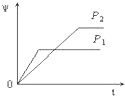 |
B、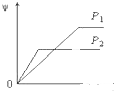 |
C、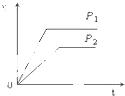 |
D、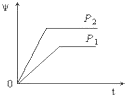 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性S<O2<F2 |
| B、半径Be2+<Mg2+<K+ |
| C、酸性H2SiO3<H3PO4<H2SO4 |
| D、还原性Se2-<S2-<O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ |
| D、向NaOH溶液中滴入少量AlCl3溶液:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com