
| A、小于0.5 |
| B、等于0.5 |
| C、大于1且小于2 |
| D、大于0.5且小于1 |
| 1 |
| 2 |
| n(H2A) |
| n(NaOH) |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
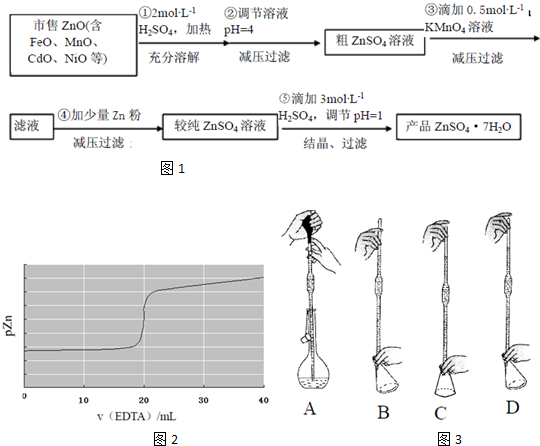
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.77×10-4 | K1=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| B、相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者 |
| C、2CN-+H2O+CO2=2HCN+CO32- |
| D、2HCOOH+CO32-=2HCOO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热的纯碱溶液用于去油污 |
| B、加热氯化铁溶液颜色变深 |
| C、饱和食盐水使甲基橙显黄色 |
| D、泡沫灭火器中的Al2(SO4)3溶液不能装在铁筒里 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加催化剂同时升高温度 |
| B、降低温度同时增大压强 |
| C、增大压强同时充入CO |
| D、加催化剂同时增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①②③ | B、②④ |
| C、④⑤⑥ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO |
| B、HMnO4 |
| C、H2CO3 |
| D、HNO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com