
 用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
| △c |
| △t |
| 0.3mol/L-0.21mol/L |
| 10min |
| c(CO2)c(N2) |
| c2(NO) |
| c(CO2)c(N2) |
| c2(NO) |
| c(CO2)c(N2) |
| c2(NO) |
| 0.34×0.17 |
| 0.322 |
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、-OH |
| B、-COOH |
| C、-C6H5 |
| D、-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.5 |
| B、等于0.5 |
| C、大于1且小于2 |
| D、大于0.5且小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、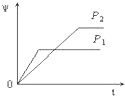 |
B、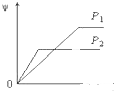 |
C、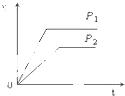 |
D、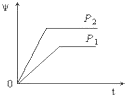 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、它们都是吸热反应 |
| B、a,b和c均为负值 |
| C、a=b |
| D、2b=c>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z) |
| C、所含电子数为(Z+n) |
| D、该粒子比M原子多n个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com