
【题目】工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1 molL-1 。
阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有 _____________,阴离子有__________。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___________________________。
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液中溶质的物质的量浓度为___________ molL-1 (精确到小数点后第三位)。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为______g。
【答案】Fe2+、Cu2+ Cl-、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 0.045 1.6
【解析】
由实验可知,Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),说明溶液中没有K+;Ⅱ.取少量溶液,加入KSCN溶液无明显变化,说明溶液中没有Fe3+;Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变,说明溶液中Fe2+与NO3-和H+反应生成NO,即溶液中含有Fe2+、NO3-,加盐酸溶液中阴离子种类不变,说明原溶液中有Cl-,加盐酸溶液依然澄清加盐酸说明溶液中没有SiO32-;Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-。
(1)由以上推断可知溶液中阴离子为Cl-、NO3-、SO42-,且各为0.1mol/L,已经推断出的阳离子是Fe2+,其浓度为0.1mol/L,由电荷守恒可知溶液中还有一种+2价阳离子,则溶液中还有Cu2+,所以甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+;阴离子是Cl-、NO3-、SO42-,故答案为:Fe2+、Cu2+;Cl-、NO3-、SO42-;
(2)Ⅲ中加入少量盐酸生成无色气体,是Fe2+与NO3-和H+反应生成Fe3+、NO和水,反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(3)二氧化氮与水反应生成硝酸和一氧化氮,反应的化学方程式为3NO2+H2O=2HNO3+NO,设标况下二氧化氮的体积为VL,则二氧化氮的物质的量为![]() =
=![]() mol,由方程式可知反应后溶液的体积为
mol,由方程式可知反应后溶液的体积为![]() L,硝酸的物质的量为
L,硝酸的物质的量为![]() ×
×![]() mol,则硝酸的物质的量浓度为
mol,则硝酸的物质的量浓度为![]() =0.045mol/L,故答案为:0.045;
=0.045mol/L,故答案为:0.045;
(4)另取100mL原溶液,加入足量的NaOH溶液,Fe2+与氢氧化钠溶液反应生成Fe(OH)2沉淀,Fe(OH)2沉淀又被空气中的氧气氧化,最终生成Fe(OH)3,Cu2+与氢氧化钠溶液反应生成生成Cu(OH)2沉淀,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为Fe2O3和CuO,根据元素守恒:n(CuO)=n(Cu2+)=cV=0.1mol/L×0.1L=0.01mol,n(Fe2O3)=n(Fe2+)/2=0.005mol,所以固体质量为:m(CuO)+m(Fe2O3)=0.01mol×80g/mol+0.005mol×160g/mol=1.6g,故答案为:1.6。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)松油醇(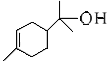 )的官能团的名称为________
)的官能团的名称为________
(2)戊烷有____种结构,请写出其中的核磁共振氢谱有1个吸收峰的结构简式__________
(3)分子式为![]() 且含两种官能团的链状有机物的结构简式为______________
且含两种官能团的链状有机物的结构简式为______________
(4)![]() 在一定条件下能生成高分子化合物的化学方程式为________________
在一定条件下能生成高分子化合物的化学方程式为________________
(5)写出甲苯生成 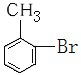 的反应方程式_____________
的反应方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,取2.05g A在纯氧中充分反应,得到2.55g固体E和一种气体G。一定条件下,A还存在如下图所示的物质转化关系,其中C、F、K是无色无味的气体单质,D、H是固体单质。反应②常用于汽车尾气的处理。
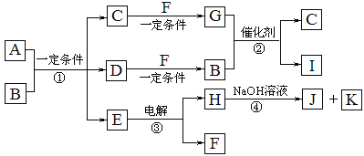
(1)C的电子式_________。
(2)A中所含元素形成的二种简单离子的半径_______大于_______。(填离子符号)
(3)反应②的化学方程式_______________________。
(4)写出反应④的离子方程式_______________________。
(5)A在潮湿的空气里不稳定,产生一种刺激性气味的气体,写出反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
(1)增加水的量或温度,都可以加快镁跟水的反应速率。
(2)增加硫酸的浓度,一定可以加快铁与硫酸反应的速率
(3)对于反应CaCO3(s)![]() CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对反应3H2(g) + N2(g)![]() 2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g)![]() 2NH3(g),使用催化剂,正逆反应速率同等程度加快。
2NH3(g),使用催化剂,正逆反应速率同等程度加快。
A. (1) (2)B. (1) (2) (3)C. (1) (2) (3) (4)D. (5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
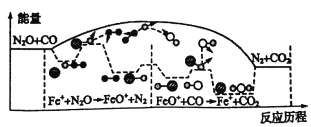
A. 反应总过程△H<0
B. Fe+使反应的活化能减小
C. 总反应若在2L的密闭容器中进行,温度越高反应速率一定越快
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热及应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A. 反应在c点达到平衡状态B. 反应物的总能量低于生成物的总能量
C. 反应物浓度:a点小于b点D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 和
和![]() 的混合气体中含电子总数为
的混合气体中含电子总数为![]()
B.![]() 氢化钾
氢化钾![]() 与足量水反应转移电子数为
与足量水反应转移电子数为![]()
C.92g甘油![]() 丙三醇
丙三醇![]() 中含C一H键总数为
中含C一H键总数为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 数之和为
数之和为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com