
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
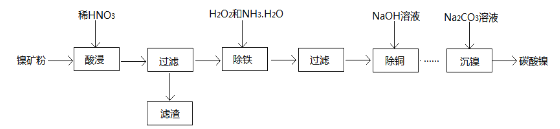
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
【答案】 3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O SiO2 NiCO3中可能混有Ni2(CO3)3 煮沸(或加热) CO32-+H2O![]() HCO3-+OH-,Ni2++2OH-=Ni(OH)2或合并书写 静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全
HCO3-+OH-,Ni2++2OH-=Ni(OH)2或合并书写 静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全
【解析】试题分析:(1)CuS与稀HNO3反应生成淡黄色固体,说明生成S单质;NiS、FeS、CuS和SiO2只有SiO2不与硝酸反应;(2)强氧化剂能把Ni2+氧化为Ni3+;H2O2加热易分解;(3)碳酸钠水解溶液显碱性,Ni2+与OH-反应生成Ni(OH)2沉淀;继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。
解析:(1)CuS与稀HNO3反应生成淡黄色固体,说明生成S单质,反应的离子方程式为3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O;NiS、FeS、CuS和SiO2只有SiO2不与硝酸反应,所以滤渣的主要成分为SiO2;(2)强氧化剂能把Ni2+氧化为Ni3+,若用过强的氧化剂,其可能的后果是NiCO3中可能混有Ni2(CO3)3杂质;H2O2加热易分解,除去多余H2O2的简便方法是煮沸;(3)碳酸钠水解溶液出碱性CO32-+H2O![]() HCO3-+OH-,Ni2+与OH-反应生成Ni(OH)2沉淀Ni2++2OH-=Ni(OH)2;检验碳酸镍沉淀完全的方法是静置、向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。
HCO3-+OH-,Ni2+与OH-反应生成Ni(OH)2沉淀Ni2++2OH-=Ni(OH)2;检验碳酸镍沉淀完全的方法是静置、向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中一定不存在的金属离子是( )
A.Fe2+和Cu2+
B.Fe3+
C.Cu2+
D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 丙烯的电子式为: ![]()
B. 二乙酸乙二酯的结构简式为: ![]()
C. 苯酚钠溶液中通入少量CO2的离子方程式为:![]() +H2O+CO2
+H2O+CO2![]()
![]() +HCO3—
+HCO3—
D. 甲醛与足量的银氨溶液反应的化学方程式为:HCHO+2Ag(NH3)2OH ![]() HCOONH4+2Ag↓+3NH3+H2O
HCOONH4+2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100 g质量分数为46%的乙醇(C2H6O)水溶液中含有的氧原子数为4NA
B. 2 mol Cu与100 mL浓度为18.4 mol·L1的浓硫酸在加热条件下充分反应,生成SO2分子数为0.92NA
C. 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D. 0.1 mol/L的Ba(OH)2溶液中,OH的个数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明稀硝酸与铜反应产物中气体为NO,设计右下图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
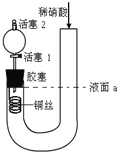
A. 关闭活塞1,加入稀硝酸至液面a处
B. 在装置左侧稍加热可以加速铜的溶解
C. 通过关闭或开启活塞1可以控制反应的进行
D. 反应开始后,胶塞下方有无色气体生成,但不能证明该气体为NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com