
【题目】(1)氢气可由天然气和水反应制备,其主要反应为CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),反应过程中能量变化如图所示:
CO2(g)+4H2(g),反应过程中能量变化如图所示:
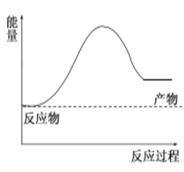
(1)若已知某些化学键的键能用字母表示如表:(计算用含a、b、c、d字母表示)。根据该反应制取1molH2要吸收或放出热量为__________
化学键 | C-H | O-H | C=O | H-H |
键能(kJ/mol) | a | b | c | d |
(2)在恒温恒容条件下反应,能说明该反应已达到平衡状态的是______________。
a.2v正(CO2)=v逆(H2O)
b.容器内密度不再发生变化
c.平均相对分子质量不再发生变化
d.当4molC-H键断裂时,同时又2molC=O键断裂
(3)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
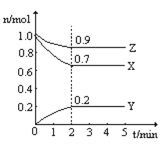
①该反应的化学方程式为__________
②反应开始至2min,气体Y的平均反应速率为__________
(4)利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,该燃料电池的正极反应式为__________。
【答案】a+b-![]() -d acd 3X+Z
-d acd 3X+Z![]() 2Y 0.05mol·L-1·min-1 O2+4e-+2H2O=4OH-
2Y 0.05mol·L-1·min-1 O2+4e-+2H2O=4OH-
【解析】
题目中的反应需根据反应物键能与生成物的键能之间的关系进行计算,判断原电池反应的正负极需要判断反应中得失电子的物质,得电子的物质为电源正极,失电子的物质为电源负极。
(1)一个化学反应的反应热可以由反应物的键能总和减去生成物的键能总和计算,根据表格数据,该反应的反应热为+(4a+4b-2c-4d)kJ/mol,即每生成4mol氢气需要从外界吸收(4a+4b-2c-4d)kJ的能量,当生成1mol氢气时,需要吸收![]() ×(4a+4b-2c-4d)=(a+b-
×(4a+4b-2c-4d)=(a+b-![]() -d)kJ的能量;
-d)kJ的能量;
(2)a.当2v正(CO2)=v逆(H2O)时,即二氧化碳的生成速率与水的生成速率比为2:1时,可以判断化学反应达到平衡状态,a正确;
b.根据质量守恒定律,反应体系内的总质量不发生变化,反应容器的体积不变,体系中混合气体的密度恒不变,不能判断反应达平衡,b错误;
c.随着反应的不断进行,反应体系中总物质的量逐渐增大,当反应达平衡时,体系中总物质的量不再发生变化,体系中的平均相对分子质量不再发生变化,可以判断反应达平衡,c正确;
d.当断裂4molC-H键指的是CH4的消耗速率,当断裂2molC=O键指的是CO2的消耗速率,当反应物的消耗速率与生成物的消耗速率比等于化学计量数比时,可以判断反应达平衡,d正确;故选择acd;
(3)根据图示,起始时X物质为1mol,平衡时为0.7mol,消耗了0.3mol;起始时Z物质为1mol,平衡时为0.9mol,消耗了0.1mol;起始时Y物质为0,平衡时为0.2mol,生成了0.2mol,故X、Z为反应物,Y为生成物,故该反应的反应方程式为3X+Z![]() 2Y;2min内Y物质的反应速率v=
2Y;2min内Y物质的反应速率v=![]() =
= =0.05mol·L-1·min-1;
=0.05mol·L-1·min-1;
(4)利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,反应中O2得到电子,在正极反应,故正极的反应式为O2+4e-+2H2O=4OH-。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl26H2O的流程如图:

(1)海水淡化的方法有蒸馏法、___(任写一种)等,考虑成本及效益试剂①可选用___。
(2)比较溶液中Br2的浓度:溶液2___溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是__。
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作包括____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒,某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用,请回答下列问题:
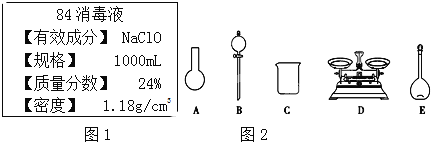
(1)此“84消毒液”的物质的量浓度约为______mol/L(计算结果保留一位小数)。
(2)某同学量取此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=___mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。
①如图2所示的仪器中配制溶液需要使用的是______(填仪器序号),还缺少的玻璃仪器是_______。
②下列操作中,容量瓶不具备的功能是_____(填仪器序号)。
a.配制一定体积准确浓度的标准溶液 b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液 d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
③请计算该同学配制此溶液需称取称量NaClO固体的质量为______g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高是______。(填序号)。
A.定容时俯视刻度线 B.转移前,容量瓶内有蒸馏水
C.未冷至室温就转移定容 D.定容时水多用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如图所示。下列说法不正确的是
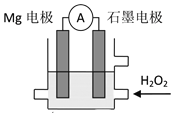
A.该电池正极的电极反应式:2H++H2O2+2e-=2H2O
B.石墨电极上发生还原反应
C.溶液中H+向石墨电极移动
D.电池工作时,电子从Mg电极经导线流向石墨电极,再由石墨电极经电解质溶液流向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B. 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1
D. N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是( )
A.用粘土焙烧制的红陶,陶器显红色的原因可能是含有![]()
B.氢氧化铝、小苏打可作胃酸的中和剂
C.烟花中添加了含铁、铂元素的化合物会更加绚丽缤纷
D.水玻璃暴露在空气中会发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
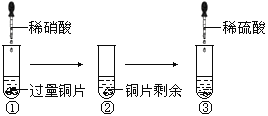
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
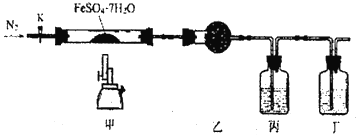
A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com