
【题目】用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是( )
A.Na2SO4 B.NaNO3 C.KOH D.CuSO4
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。

(4)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向 极移动(填“正”或“负”)。
②该电池正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.H2O与BeCl2为V形
B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形
D.SO3与CO为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种有机物A、B、C、D、E,其中A、B、D是烃类,其它为含氧衍生物;A与E碳数相同、B比D少一个碳原子,且互为同系物。常温常压下A为气体,B、C、D、 E是液体。已知: (1)A可以聚合;完全燃烧1molA,需氧气3mol。
(2)B的蒸气对氢气的相对密度是39,完全燃烧7.8g B,需氧气16.8L(标准状态)。
(3)C与浓硫酸共热得A,C经氧化可得E。
(4)E与Na2CO3溶液混和有气体产生。
根据上述推断回答下列:①各物质的结构简式:
A B C D E
②写出下列化学方程式
ⅰ、 C催化氧化:
ⅱ、 B和浓硫酸、浓硝酸混合加热:
ⅲ 、C、E和浓硫酸混合加热:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法不正确的是( )

A.Na2O2中阴阳离子数目之比为1∶2
B.反应①的离子方程式为:Na+2H2O===Na++2OH-+H2↑
C.反应③最多能产生0.05 mol O2
D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据各题要求填空
(1)聚乳酸纤维是一种新型可降解的高分子材料,主要以玉米、小麦、甜菜等含淀粉的农产品为原料,先水解为葡萄糖,经发酵生成乳酸后,再经缩聚和熔融纺丝制成。聚乳酸材料废弃后,它在土壤或海水中,先水解成乳酸,经微生物作用可分解为二氧化碳和水。请用化学方程式表示上述的整个过程的化学反应。
乳酸的结构为:![]()
①___________________________;
②___________________________;
③___________________________;
④___________________________;
⑤___________________________;(可以留空也可以自行补充)
(2)已知CH3Cl+2Na+CH3Cl→CH3—CH3+2NaCl,现有CH3CH2Br和CH3CHBrCH3的混合物与金属钠反应后,可能得到的烃的结构简式及名称是:
①___________________________;
②___________________________;
③___________________________;
④___________________________;(可以留空也可以自行补充)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂。实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯PCl3 + 4C2H5OH → HPO(OC2H5)2 + HCl↑+2C2H5Cl + H2O;实验步骤如下:
①将40mL三氯甲烷和36.8g(0.8mol)无水乙醇混合后加入250mL三颈烧瓶中。
②从仪器A中滴加20mL三氯甲烷和27.5g (0.2mol)PCl3混合溶液,用冰水控温6~8℃,开动搅拌器,约1h滴加完毕。
③将反应物倒入烧杯中,用10%的碳酸钠溶液中和至pH为7~8,再用去离子水洗涤三次,在仪器B中分离。
④减压蒸馏,收集产品,得23.32g产品。
(1)装置图中仪器A叫做恒压滴液漏斗,与分液漏斗比,滴液时的优点是 ;步骤③中仪器B名称为 。图中NaOH溶液的作用为 。
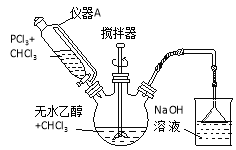
(2)用碳酸钠溶液洗涤的目的是 ;用去离子水洗涤的目的是 。
(3)减压蒸馏除得到产品外还可回收的有机物有 (写两个的结构简式)。
(4)从无水乙醇利用角度计算,本次实验产率为 (填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素是最活泼的一族非金属元素,下列关于卤素(用X表示)的叙述正确的是
A. 单质均能与水反应生成HXO
B. 从上到下,HX的氧化性增强,对应水溶液酸性增强
C. 从上到下,卤素原子的电子层数依次增多,原子半径依次增大
D. 卤素均能形成最高价含氧酸,其分子通式为HXO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 3mol A 和 2.5mol B 混合于 2L 的密闭容器中,使它们发生反应:3A(气) + B(气) ![]() xC(气) + 2D(气),经5min后达到平衡生成1mol D,并测定C的平均速率为0.1 mol/L·min,则此反应中的B的转化率为________,C的系数为_______________,A的平衡浓度为_____________。
xC(气) + 2D(气),经5min后达到平衡生成1mol D,并测定C的平均速率为0.1 mol/L·min,则此反应中的B的转化率为________,C的系数为_______________,A的平衡浓度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com