
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是: 。

(4)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向 极移动(填“正”或“负”)。
②该电池正极的电极反应式为 。
【答案】
(1)-41.8
(2)BD 1.8
(3)<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失
(4)负; O2+2H2O+4e-=OH-
【解析】
试题分析:(1)已知:①2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6kJmol-1,②2NO(g)+O2(g)
2SO3(g)△H=-196.6kJmol-1,②2NO(g)+O2(g) ![]() 2NO2(g)△H=-113.0kJmol-1,利用盖斯定律将①×
2NO2(g)△H=-113.0kJmol-1,利用盖斯定律将①×![]() -②×
-②×![]() 得NO2(g)+SO2(g)
得NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H=
SO3(g)+NO(g)△H=![]() ×(-196.6kJmol-1)-
×(-196.6kJmol-1)-![]() ×(-113.0kJmol-1)=-41.8kJmol-1,故答案为:-41.8;
×(-113.0kJmol-1)=-41.8kJmol-1,故答案为:-41.8;
(2)A.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故A错误;B.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故B正确;C.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故C错误;D.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时消耗1molNO,现在同时生成1mol NO,表示正逆反应速率相等,能判断是否达到平衡状态,故D错误,故答案为:BD;
(3)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强.故答案为:<,在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
(4)①依据甲醇燃烧的反应原理,结合如图所示的原电池装置,负极上失电子发生氧化反应,正极上得到电子发生还原反应;一般燃料在负极上发生反应,氧气再正极发生还原反应;负极电极反应为:CH3OH+8OH--6e-=CO32-+6H2O;阴离子移向负极;正极电极反应为:O2+2H2O+4e-=4OH-;故答案为:负;O2+2H2O+4e-=4OH-。


科目:高中化学 来源: 题型:
【题目】配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是
A.FeSO4(Fe) B.SnCl2(HCl) C.FeCl3(HCl) D.NaAlO2(NaOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法、乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是__________;
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、玻璃棒、__________,操作Ⅱ的名称是__________;操作Ⅲ的名称是__________;
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。如图所示的是用燃烧法确定青蒿素分子式的装置。
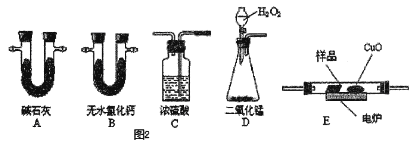
①按上述所给的测试信息。装置的连接顺序应是__________(每个装置限用一次)。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是__________;
③青蒿素样品的质量为28.2 g。用合理改进后的装置进行试验,称得A管增重66 g,B管增重19.8 g,则测得青蒿素的最简式是__________。
④要确定该有机物的分子式,还必须知道的数据是__________。
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,与青蒿素化学性质相似的物质是__________(填字母代号)
A.乙醇 B.乙酸 C.葡萄糖 D.乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为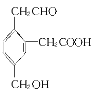 ,该有机化合物属于 ( )
,该有机化合物属于 ( )
①芳香烃 ②芳香族化合物 ③醇④羧酸 ⑤酯 ⑥醛 ⑦烃的衍生物⑧不饱和有机物⑨多官能团有机物
A.②③④
B.①③⑤⑥
C.①③④⑤⑥⑦
D.②③④⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用右图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是______________________。
(2)观察到_____________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)写出溴乙烷与NaOH溶液发生的反应方程式 ,为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______________,检验的方法是 (需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是
A.两者都为s-s σ 键
B.两者都为p-p σ 键
C.前者为p-p σ 键,后者为s-p σ 键
D.前者为s-s σ 键,后者为s-p σ 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 | |
下列判断中,正确的是( )
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、N、C![]() 、N、OH-、S
、N、OH-、S![]() ,将这4种溶液分别标记为A、B、C、D并进行如下实验:①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
,将这4种溶液分别标记为A、B、C、D并进行如下实验:①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)A的化学式是 ,判断理由是 。
(2)写出其他几种物质的化学式:B 、C 、D 。
(3)写出实验③中气体被B吸收的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是( )
A.Na2SO4 B.NaNO3 C.KOH D.CuSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com