
【题目】X、Y、Z、 W均为元素周期表中前20号元素,其原子序数依次增大。已知:X与Y可形成原子个数比为1![]() 1的化合物。Z、W简单离子的电子层结构相同。下列说法正确的是
1的化合物。Z、W简单离子的电子层结构相同。下列说法正确的是
A. 若X为IA族时,Y不可能是第三周期VIA族元素
B. 由X、Y、Z、 W四种元素不可能形成其原子个数比为1![]() 1
1![]() 3
3![]() 1的化合物
1的化合物
C. Z元素的离子半径一定小于W元素的离子半径
D. 若X为IVA族元素时,X、Y两元素可形成含有共价键的离子化合物
【答案】D
【解析】A. 若X为IA族时,Y是第三周期VIA族元素,为S元素,二者不能形成XY或X2Y2形化合物,故A错误;B. X与Y可形成原子个数比为1![]() 1的化合物,X与Y可能是C、H。Z、W简单离子的电子层结构相同,可能是O、Na,可能组成原子个数比为1
1的化合物,X与Y可能是C、H。Z、W简单离子的电子层结构相同,可能是O、Na,可能组成原子个数比为1![]() 1
1![]() 3
3![]() 1的化合物为碳酸氢钠,故B错误;C. Z、W简单离子的电子层结构相同,则Z为第2周期的后半段元素,W为第3周期前半段的元素,或Z为第3周期的后半段元素,W为第4周期前半段的元素,根据电子层结构相同的元素,核电荷数越大,离子半径越小, Z元素的离子半径一定大于W元素的离子半径,故C错误;D. 若X为IVA族的碳元素时,Y可能为钠元素,X、Y两元素可形成Na2C2,属于含有共价键的离子化合物,故D正确;故选D。
1的化合物为碳酸氢钠,故B错误;C. Z、W简单离子的电子层结构相同,则Z为第2周期的后半段元素,W为第3周期前半段的元素,或Z为第3周期的后半段元素,W为第4周期前半段的元素,根据电子层结构相同的元素,核电荷数越大,离子半径越小, Z元素的离子半径一定大于W元素的离子半径,故C错误;D. 若X为IVA族的碳元素时,Y可能为钠元素,X、Y两元素可形成Na2C2,属于含有共价键的离子化合物,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】下列变化不属于氮的固定的是( )
A. 根瘤菌把氮气转化为氨
B. 氮气和氢气在适宜条件下合成氨
C. 氮气和氧气在放电条件下合成一氧化氮
D. 工业上用氨和二氧化碳合成尿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
(1)与化石燃料相比,氢气作为燃料的优点是_________(至少答出两点)。
(2)与氢气直接燃烧相比较,设计成镍氢电池可以大大提高能量的转换率,在镍氢电池充电过程中储氢合金(M)吸氢转化为MH2,总反应为:xNi(OH)2+M![]() xNiOOH+MHx,试写出放电过程中负极
xNiOOH+MHx,试写出放电过程中负极
反应式____________。
(3)施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,已知NaBH4与水反应后所得溶液显碱性,溶液中各离子浓度大小关系为__________,用离子方程式表示出溶液显碱性的原因_______________。
(4)在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入ag的储氢合金(M)和bmol氢气发生如下反应:2M(s)+xH2(g)![]() 2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。
2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。

(5)储氢还可以借助有机物,如利用乙苯与苯乙烯之间的可逆反应来实现脱氢和加氢;

①在恒容密闭容器中,控制不同温度进行乙苯的脱氢实验。以乙苯起始浓度均为c mol/L测定乙苯的转化率,结果如图2所示。图中A为乙苯的平衡转化率与温度关系曲线,B曲线表示不同温度下反应经过相同时间且为达到化学平衡时乙苯的转化率。试说明随温度的升高,曲线B向曲线A逼近的原因__________。
②维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转换率为a,则在该温度下反应的平衡常数K=__________(用a等符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黑色固体粉末可能是 Fe、FeO、CuO、C 中一种或几种。为了探究其成分,小明同学按照下 图所示流程进行了实验。
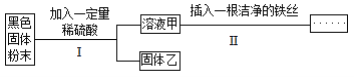
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定含有 Fe;
②若步骤Ⅱ中无明显现象,则固体乙中最多只能 有四种物质;
③若步骤Ⅱ中 有气泡产生,则原固体可能是纯净物也可能是混合物;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无 CuO;
⑤固 体乙呈红色,则原固体中一定含有 Fe 和 CuO。 以上说法中正确的个数是
A. 1 个 B. 2 个 C. 3 个 D. 4 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是 ( )
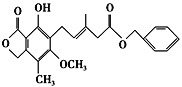
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1 mol该化合物最多可以与3 mol NaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 不可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的能源,也是生产化工产品的重要原料。随着人类社会的飞速发展,化石能 源大量消耗,人类已经面临较严重的能源危机。为此,提高能源的利用率和开发更多的新能源 显得相当重要。下图是煤化工产业链的一部分。
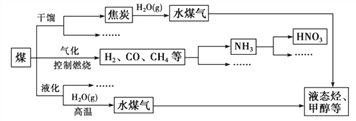
请回答:
(1)任意列举两项新能源_____。
(2)上述处理煤的过程属于_____(填“物理”或“化学”)变化。
(3)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是 将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达 60%)成分的水溶液里,其中一种反应的化学方程式是:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则 X 的名称是_____。
(4)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
![]()
这种脱硫技术称为微生物脱硫技术。该技术的两步反应的化学方程式依次是_____________ 。
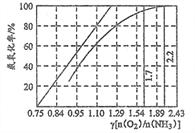
(5)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨—空 气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到 100%,理论上 γ[n(O2)/n(NH3)]=1.25,实际 生产要将 γ 值维护在 1.7~2.2 之间, 原因是___________。 [温馨提示:n(O2)是可以认为是表示氧气分子堆积数目的一种物理量,即 n(O2)值越大,说明氧分子数目 越多]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代名臣于谦作诗“凿开混沌得乌金,藏蓄阳和意最深。爝火燃回春浩浩,洪炉照破夜沉沉……”,诗中所写“乌金”是( )
A. 焦炭 B. 煤炭 C. 磁铁矿 D. 软锰矿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种措施,其中能减少酸雨产生的措施是( )
①对燃烧煤时产生的尾气进行除硫处理 ②少用原煤作燃料 ③燃煤时鼓入足量空气 ④开发清洁能源
A. ①②③ B. ②③④
C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,将1L混合烃与9L氧气混合没在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是
A. 甲烷与乙烷的体积比是1∶4 B. 丙炔与乙炔的体积比是1∶4
C. 乙烯与丁烷的体积比是1∶4 D. 乙烯与丁烯的体积比是1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com