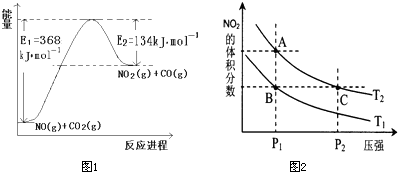
解答:解:(1)该反应的焓变△H=E
1-E
2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为NO
2(g)+CO(g)=CO
2(g)+NO(g)△H=-234kJ?mol
-1,
故答案为:NO
2(g)+CO(g)=CO
2(g)+NO(g)△H=-234kJ?mol
-1;
(2)①N
2(g)+3H
2(g)?2NH
3(g)△H<0,平衡常数计算表达式K=
,
故答案为:
;
②N
2(g)+3H
2(g)?2NH
3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K
1>K
2,
故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N
2、H
2、NH
3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N
2)
正=v(H
2)
逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选:c;
(3)a.A、C两点都在等温线上,压强越大,反应速率越快,所以速率为C>A,故A错误;
b.A、C两点都在等温线上,平衡常数只与温度有关,所以化学平衡常数为A=C,故B错误;
c.A、C两点都在等温线上,C点压强更高,压强增大,平衡向气体体积减少的方向移动,即逆反应方向移动,N
2O
4的转化率降低,所以两点N
2O
4的转化率为A>C,故C正确;
d.该反应为吸热反应,升高温度平衡向正反应方向移动,NO
2的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
故选:cd.
(4)在1L密闭容器中,充入1mol N
2和3mol H
2,一定条件下发生合成氨反应,10min时达到平衡,依据平衡三段式列式,设氮气转化的物质的量为x,
N
2+3H
2=2NH
3起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
平衡混合气体的总物质的量为原来的7/8,则
=
,
得到x=0.25mol,所以N
2的转化率a(N
2)=
×100%=25%,
c(NH
3)=
=0.5mol/L,所以v(NH
3)=
=0.05mol/(L?min),
故答案为:25%;0.05mol/(L?min);
(5)实验室用氯化铵和熟石灰加热制取氨气,化学反应方程式为:2NH
4Cl+Ca(OH)
22 NH
3↑+CaCl
2+2H
2O,
故答案为:2NH
4Cl+Ca(OH)
22 NH
3↑+CaCl
2+2H
2O.




 阅读快车系列答案
阅读快车系列答案 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.