
【题目】(1)钒是第四周期元素,工业上有广泛应用。写出钒原子的价电子排布图______________,V2O5常用作SO2转化为SO3的催化剂,S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型为_________________.
![]()
(2)光气(COCl2)是一种重要的有机中间体,其分子的立体构型为_________,其三种元素的电负性由小到大的顺序为___________________,写出与COCl2互为等电子体的分子和离子:___(各写一种)。
(3)[Co(N3)(NH3)5]SO4中Co的配位数为_________,其配离子中含有的化学键类型为__________,C、N、O中第一电离能最大的为_______,其原因是____________________。
(4)如图为金刚石的晶胞,其中原子坐标参数为A(0,0,0);B(![]() ,0,
,0,![]() );C(
);C(![]() ,
,![]() ,
,![]() );则D原子的坐标参数为__________。
);则D原子的坐标参数为__________。
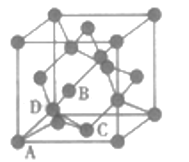
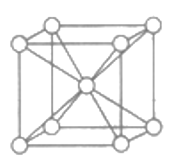
(5)晶体锌为体心立方结构,如图所示。已知锌晶体的密度为dg/cm3,NA代表阿伏加德罗常数的值。锌晶体中锌原子之间最近的核间距(D)=_______mm。
【答案】![]() sp3 平面三角形 C<Cl<O SO3(或BF3、N2Cl2等合理答案)、CO32-(或NO3-等合理答案) 6 共价键、配位键 N 氮原子2p轨道为半充满状态,较稳定,不易失去电子
sp3 平面三角形 C<Cl<O SO3(或BF3、N2Cl2等合理答案)、CO32-(或NO3-等合理答案) 6 共价键、配位键 N 氮原子2p轨道为半充满状态,较稳定,不易失去电子 ![]()
![]()
【解析】
(1)V为23号元素,其价电子排布式为3d34s2,则其价电子排布图为![]() ;S8为环状立体结构,每个S原子形成2个σ键,S上还有两对孤电子对,故S原子的杂化类型为sp3。
;S8为环状立体结构,每个S原子形成2个σ键,S上还有两对孤电子对,故S原子的杂化类型为sp3。
(2)光气的结构式为![]() ,碳原子的孤电子对数为0,价层电子对数为3,则其空间结构为平面三角形;同一周期从左到右元素的电负性逐渐增大,元素的非金属性越强电负性越大,所以C、O、Cl三种元素的电负性由小到大的顺序为C<Cl<O;原子总数相等,价电子总数也相等的微粒互为等电子体,COCl2的等电子体有SO3、BF3、N2Cl2等分子和CO
,碳原子的孤电子对数为0,价层电子对数为3,则其空间结构为平面三角形;同一周期从左到右元素的电负性逐渐增大,元素的非金属性越强电负性越大,所以C、O、Cl三种元素的电负性由小到大的顺序为C<Cl<O;原子总数相等,价电子总数也相等的微粒互为等电子体,COCl2的等电子体有SO3、BF3、N2Cl2等分子和CO![]() 、NO等离子。
、NO等离子。
(3)[Co(N3)(NH3)5]SO4中N3-、NH3都是配体,故Co的配位数是6;N3-、NH3中存在共价键,配体与中心离子间形成配位键,所以配离子中含有的化学键类型为共价键、配位键;同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但氮原子2p轨道为半充满状态,相对稳定,更不易失去电子,所以第一电离能最大的为N。
(4)由图可知,与D相连的4个原子形成正四面体,且D位于正四面体的体心。由B在x轴的坐标为![]() 知,D在x轴的坐标为
知,D在x轴的坐标为![]() ,同理得出D在y、z轴的坐标均为
,同理得出D在y、z轴的坐标均为![]() ,则D的坐标参数为
,则D的坐标参数为![]() 。
。
(5)晶胞体对角线上的锌原子相切,设锌原子半径为r,晶胞边长为a,则有![]() ,一个晶胞含有2个锌原子,则有
,一个晶胞含有2个锌原子,则有![]() ,a=
,a=![]() cm,锌原子之间最近的核间距离是
cm,锌原子之间最近的核间距离是![]() 。
。


科目:高中化学 来源: 题型:
【题目】研究含N、S的污染排放物并妥善处理和利用,意义重大。回答下列问题:
(1)![]() 尾气先用氨水吸收生成
尾气先用氨水吸收生成![]() ,反应为
,反应为![]()
![]() ,再将
,再将![]() 氧化为
氧化为![]() ,最终实现副产氮肥,变废为宝。两种氧化方案如下:
,最终实现副产氮肥,变废为宝。两种氧化方案如下:
方案1:![]()
方案2:![]() ,
,
![]() 。
。
30℃时,分别向两相同容器中加入100L 0.4![]() 溶液,加入足量相同物质的量的氧化剂,测得
溶液,加入足量相同物质的量的氧化剂,测得![]() 的氧化率X(%)随时间的变化如图所示。
的氧化率X(%)随时间的变化如图所示。
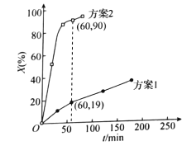
据上述图像判断,氧化![]() 为
为![]() 的能力是
的能力是![]() ____(填“大于”或“小于”)
____(填“大于”或“小于”)![]() ,可能的原因是___。
,可能的原因是___。
②60min内测得方案2体系中用![]() 表示的反应速率为__
表示的反应速率为__![]() 。
。
(2)方案2中,![]() 会被氧化成
会被氧化成![]() ,而
,而![]() 不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加
不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加![]() 将
将![]() 还原成
还原成![]() ,同时生成
,同时生成![]() 。反应历程如下:
。反应历程如下:
i:![]()
ii:_____
iii:![]()
iv:![]()
则第ii步反应为____。
(3)利用废气中的![]() 将(2)中生成的
将(2)中生成的![]() 还原成
还原成![]() ,以实现
,以实现![]() 再生。反应的离子方程式为____。
再生。反应的离子方程式为____。
![]() 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化![]() 为
为![]() 的过程,则整个过程中起催化剂作用的是___(填离子符号)。
的过程,则整个过程中起催化剂作用的是___(填离子符号)。
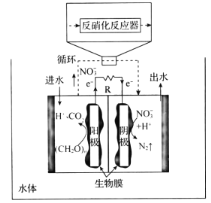
(4)关于微生物电化学系统处理含氮废水的研究快速发展,如图是一种新型的浸没式双极室脱盐-反硝化电池。由阳极室和阴极室组成,中间由质子交换膜隔开,阳极室中的有机物则被微生物氧化降解产生电子和质子,其中的![]() 通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成
通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成![]() 。
。
①微生物电化学系统处理有机含氮废水的优点是____。
②写出负极发生反应的电极反应式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素A、B、C、D。A元素M层上电子数是K层的3倍,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
(1)A的离子结构示意图是__________________。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:____________。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,但不能用它干燥H2S气体,其原因是___________(用化学反应的化学方程式表示)
(3)B与C元素形成带一个单位正电荷的离子,写成该微粒的电子式_________。写出实验室检验溶液中该离子的简单实验方案:___________________________。
(4)元素A与元素D相比,非金属性较强的是_________(用元素符号表示),下列表述中能表明这一事实的是_________。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)元素B、C与D组成的化合物固态时属于_______________晶体。
①原子晶体 ②离子晶体 ③分子晶体 ④分子晶体或离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA
B.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA
C.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA
D.标准状况下,11.2L H2O含有0.5NA分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
(1)写出下列物质在水溶液中的电离方程式:
NaHCO3__________________
KHSO4________________________________________________
CH3COOH____________________________
Al(OH)3 ________________
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应_____________
氢氧化铜溶液与稀硫酸反应______________
氯气和水反应_____________
氧化镁与稀硫酸反应_________________
(3)写出与下列离子方程式相对应的化学方程式:
H+ + OH- =H2O _____________
CO32- + 2H+=CO2↑+ H2O_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由有机化合物A为原料制备高聚物X和Y的合成路线如图:
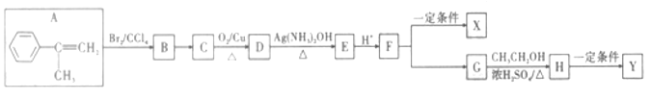
回答下列问题:
(1)A的化学名称是___________,X的结构简式为___________________。
(2)H中所含官能团名称是_____________________。
(3)B→C的反应条件是_________,F→G的反应类型是________________。
(4)D→E的化学方程式为__________________。
(5)W为G的同分异构体,符合下列条件的W的同分异构体共有_________种。(不考虑立体异构)。
①能发生银镜反应
②遇FeCl3溶液显紫色
③能使溴的四氯化碳溶液褪色
其中核磁共振氢有6组峰,且峰面积之比为1:1:1:1:2:2的结构简式为_____________。
(6)已知: 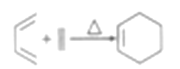
请写出以![]() 和
和![]() 为原料制
为原料制![]() 的合成路线流程图(其他试剂任选,合成路线流程图示例见本题题干)______________
的合成路线流程图(其他试剂任选,合成路线流程图示例见本题题干)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列叙述正确的是
A. 14 g乙烯与丙烯的混合气体中所含氢原子数目为2NA ; 18 g H2O与18 g D2O所含电子数均为10NA
B. 56 g铁片投入足量浓H2SO4中生成NA个SO2分子;密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
C. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA ;0.1molCl2溶于足量水中,转移的电子数小于0.1NA
D. 25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA ;1 L 0.1 mol·L-1的Na2CO3溶液中所含氧原子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是
A. 该反应的氧化剂只有Cu2O B. Cu既是氧化产物,又是还原产物
C. Cu2S既是氧化剂又是还原剂 D. 还原产物与氧化产物的物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:
回答下列问题:
(1)B的结构简式为____________,C中含有的官能团名称是______________。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为______________,⑥的反应类型是________________。
(3)写出苯乙醛与新制的银氨溶液反应的离子方程式:___________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:________________。
i .含有苯环和 ![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)__________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的无机试剂制
的合成路线,写出由2-氯丙烷和必要的无机试剂制 的合成流程图:___________________。合成流程图示例如下:CH2=CH2
的合成流程图:___________________。合成流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com