
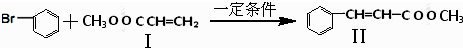

 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为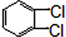 为原料合成
为原料合成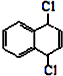 的路线.
的路线.| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
 发生取代反应生成
发生取代反应生成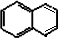 ,然后与氯气发生1,4-加成,可生成
,然后与氯气发生1,4-加成,可生成 .
.| 醇 |
| △ |
| 醇 |
| △ |
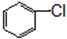
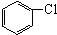 与
与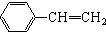 也可以发生类似反应①的反应,其有机产物的结构简式为,
也可以发生类似反应①的反应,其有机产物的结构简式为, ,
, ;
; 发生取代反应生成
发生取代反应生成 ,然后与氯气发生1,4-加成,可生成
,然后与氯气发生1,4-加成,可生成 ,反应流程为CH3CHClCHClCH3
,反应流程为CH3CHClCHClCH3| NaOH、乙醇 |
| △ |

| 一定条件 |

| Cl2 |
| 一定条件下 |
 ,
,| NaOH、乙醇 |
| △ |

| 一定条件 |

| Cl2 |
| 一定条件下 |
 .
.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4?7H2O进行消毒、净化,以改善水质 |
| B、铝表面有一层致密的氧化薄膜,故铝制容器可用来腌制咸菜等 |
C、 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: |
| D、借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 污渍爆炸盐 | 漂白粉 |
| 产品样式 |  |  |  |  |  |
| 有效成分 或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 | 消毒 |
| 实验步骤 | 实验现象 | 实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体, | 漂白粉的漂白作用已完全失效. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
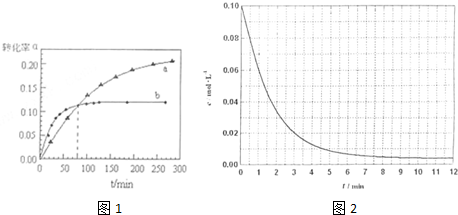
| △n(40℃) |
| △n(60℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:
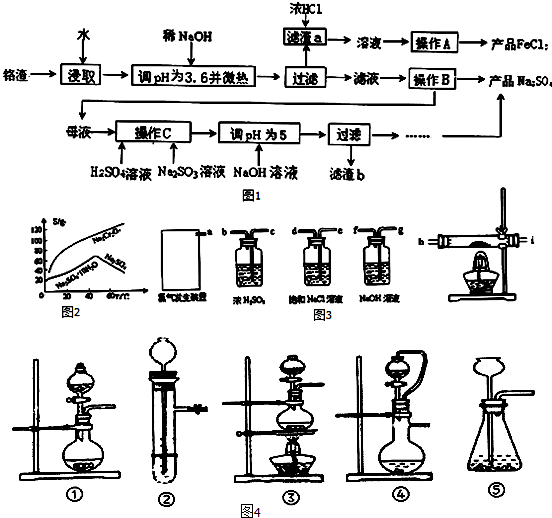
查看答案和解析>>
科目:高中化学 来源: 题型:
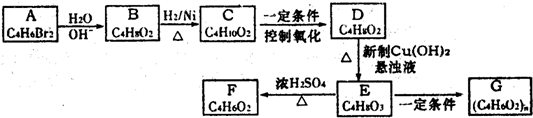
查看答案和解析>>
科目:高中化学 来源: 题型:
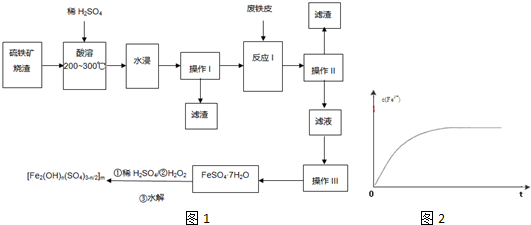
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、25% |
| C、80% | D、85% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com