
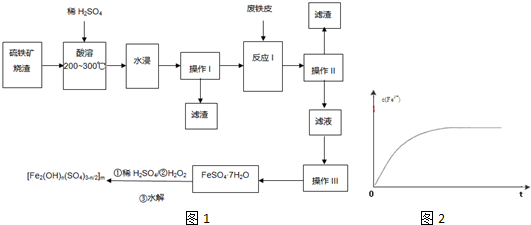
 FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O; FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O;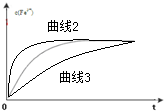 ;
; ;
;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
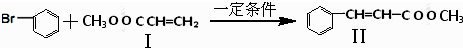

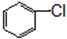 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为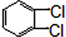 为原料合成
为原料合成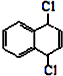 的路线.
的路线.| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
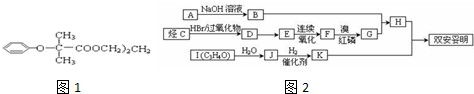
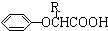
| Br2,红磷 |
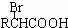
| 苯酚钠 |
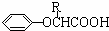
| HBr,过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

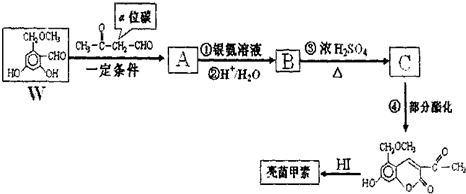
查看答案和解析>>
科目:高中化学 来源: 题型:
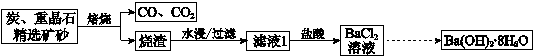
| 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| Ba(OH)2?8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |

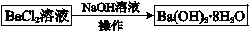
查看答案和解析>>
科目:高中化学 来源: 题型:
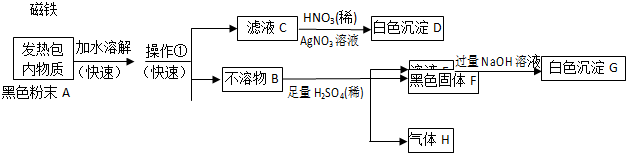
查看答案和解析>>
科目:高中化学 来源: 题型:
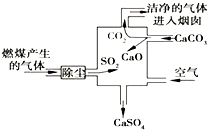
| A、进入烟囱的气体为纯净物 |
| B、此过程中硫元素的化合价没有发生改变 |
| C、使用此废气处理装置可减少酸雨的形成 |
| D、整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com