

 ×1010(2分) 20(1分)
×1010(2分) 20(1分)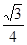 ,设晶胞棱长是bpm,则晶胞的密度a=8×18/NA/(b×10-10)3,b=
,设晶胞棱长是bpm,则晶胞的密度a=8×18/NA/(b×10-10)3,b=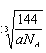 ×1010,所以两个X2Z分子间的最近距离为
×1010,所以两个X2Z分子间的最近距离为 ×1010;冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol;
×1010;冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol;

科目:高中化学 来源:不详 题型:单选题
| A.第ⅠA族元素都比第ⅡA族元素金属性强 |
| B.只含有非金属元素的化合物可能是离子化合物 |
| C.只含有共价键的物质一定是共价化合物 |
| D.同主族元素原子半径越小越容易失去电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4与SiH4的稳定性:CH4>SiH4 |
| B.HClO与H2SO4的酸性:HClO >H2SO4 |
| C.1molHCl(g)的能量比1molH2(g)和1molCl2(g)的能量和高 |
| D.Cl与S的原子半径:Cl >S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 |
| B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W |
| C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键 |
| D.由Y和T组成的物质YT,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.其最高化合价为+3 | B.可以形成化学式为KXO3的盐 |
| C.其氢化物可以用来做喷泉实验 | D.其最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.固体M能与水反应生成X单质和一种强碱 |
| B.Z单质的薄片在酒精灯上加热能熔化,但不滴落 |
| C.Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 |
| D.M和N中均含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

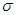 键与π键的数目之比为_________;
键与π键的数目之比为_________;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com