
【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。 合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/ kJmol﹣1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)
2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)![]() N2(g)+3H2(g)的活化能Ea=_____。
N2(g)+3H2(g)的活化能Ea=_____。
②下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。

③依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_______________。

(2)选择性催化还原脱硝技术(SCr)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCr脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。

②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
③直接电解吸收也被用于脱硝。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。阳极的电极反应式为_____。

【答案】 600 kJmol﹣1 14.5% 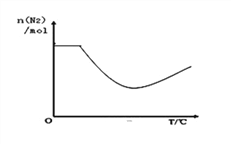 过量氨气与氧气反应生成 NO 2NO2+2Na2CO3+H2O=NaNO3+NaNO2+2NaHCO3 H2O + HNO2 - 2e-= NO3 -+3H+
过量氨气与氧气反应生成 NO 2NO2+2Na2CO3+H2O=NaNO3+NaNO2+2NaHCO3 H2O + HNO2 - 2e-= NO3 -+3H+
【解析】(1)①N2(g)+3H2(g)![]() 2NH3(g)的反应热△H=反应物总键能-生成物总键能=(946+436×3)kJmol﹣1-(6×391)kJmol﹣1=-92 kJmol﹣1,正反应的活化能Ea=508 kJmol﹣1,则逆反应的活化能Ea=(508+92)kJmol﹣1=600kJmol﹣1,即2NH3(g)
2NH3(g)的反应热△H=反应物总键能-生成物总键能=(946+436×3)kJmol﹣1-(6×391)kJmol﹣1=-92 kJmol﹣1,正反应的活化能Ea=508 kJmol﹣1,则逆反应的活化能Ea=(508+92)kJmol﹣1=600kJmol﹣1,即2NH3(g)![]() N2(g)+3H2(g)的活化能Ea=600kJmol﹣11;②设平衡时反应的氮气的物质的量为xmol,则根据方程式可知
N2(g)+3H2(g)的活化能Ea=600kJmol﹣11;②设平衡时反应的氮气的物质的量为xmol,则根据方程式可知
N2(g)+3H2(g)![]() 2NH3(g),
2NH3(g),
起始(mol) 1 3 0
反应(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
平衡时氨气的体积分数=![]() =42%,解得x=0.592mol,则N2的平衡体积分数=
=42%,解得x=0.592mol,则N2的平衡体积分数=![]() =14.5%;③N2(g)+3H2(g)
=14.5%;③N2(g)+3H2(g)![]() 2NH3(g)△H= -92 kJmol﹣1,升高温度,平衡逆向移动,N2物质的量增大,因此一定条件下的密闭容器内,从通入原料气开始,随着反应的进行,氮气的物质的量逐渐减小,达到平衡后,随温度不断升高,氮气的物质的量逐渐增大,图像为
2NH3(g)△H= -92 kJmol﹣1,升高温度,平衡逆向移动,N2物质的量增大,因此一定条件下的密闭容器内,从通入原料气开始,随着反应的进行,氮气的物质的量逐渐减小,达到平衡后,随温度不断升高,氮气的物质的量逐渐增大,图像为 ;(2)①4NH3(g)+4NO(g)+O2(g)
;(2)①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1,350℃时,只改变氨气的投放量,当n(NH3)/n(NO)>1.0时,过量氨气与氧气反应生成NO,烟气中NO浓度反而增大;②NO2被Na2CO3溶液吸收生成三种盐,二氧化氮与水反应生成一氧化氮和硝酸,一氧化氮和二氧化氮与碱反应能够生成亚硝酸盐,因此反应的化学反应方程式为2NO2+2Na2CO3+H2O=NaNO3+NaNO2+2NaHCO3;③用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,根据装置图,阳极发生氧化反应,亚硝酸被氧化为硝酸,电极反应式为H2O+HNO2-2e-=NO3-+3H+。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1,350℃时,只改变氨气的投放量,当n(NH3)/n(NO)>1.0时,过量氨气与氧气反应生成NO,烟气中NO浓度反而增大;②NO2被Na2CO3溶液吸收生成三种盐,二氧化氮与水反应生成一氧化氮和硝酸,一氧化氮和二氧化氮与碱反应能够生成亚硝酸盐,因此反应的化学反应方程式为2NO2+2Na2CO3+H2O=NaNO3+NaNO2+2NaHCO3;③用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,根据装置图,阳极发生氧化反应,亚硝酸被氧化为硝酸,电极反应式为H2O+HNO2-2e-=NO3-+3H+。


科目:高中化学 来源: 题型:
【题目】某温度下,已知反应mX(g)+nY(g)![]() qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
A. 反应速率v逆(Y)=![]() v正(X) B. 增加Y的物质的量,X的转化率增大
v正(X) B. 增加Y的物质的量,X的转化率增大
C. 降低温度,![]() 的值变小 D. 加入X,反应的ΔH增大
的值变小 D. 加入X,反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种常见化合物,已知它们包含的阳离子有K+、Ag+、Na+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、AlO2-、NO3-、SO42-、CO32-。将它们分别配成0.1mol·L-1的溶液进行如下实验:
①测得A、C、E溶液均呈碱性,且碱性A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;④向D溶液中滴加Ba(NO3)2溶液,无明显现象。
(1)写出A、D、E、F的化学式:A.________;D.________;E._______;F.________。
(2)用离子方程式解释C溶液呈碱性的原因:____________________________________。
(3)写出实验③中反应的离子方程式: ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A标准状况下的密度为1.16 g·Lˉ1,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。F为有浓郁香味,不易溶于水的油状液体。

请回答:
(1)A的结构简式________________。
(2)D+E→F的反应类型是__________。
(3)有机物A转化为B的化学方程式是___________________________________。
(4)下列说法正确的是_________。
A.有机物E与金属钠反应比水与金属钠反应要剧烈。
B.有机物E与金属钠反应的产物可以与水反应重新生成E。
C.有机物D、E、F可用饱和Na2CO3溶液鉴别。
D.上述转化关系图中共涉及3次加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(![]() ×100%)随温度的变化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
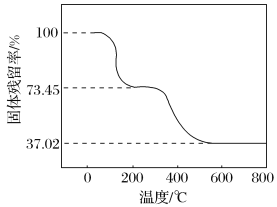
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH- )∶n(CO32- ) _________________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液,其pH为____________,此时水的电离受到______________.
(2)已知:2NO2(g)![]() N2O4(g)△H=﹣57.20kJmol﹣1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)△H=﹣57.20kJmol﹣1.一定温度下,在密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是_____________(填字母)
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是_____________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2,则该温度下:
①0.01molL﹣1NaOH溶液的pH=__________;
②100mL 0.1molL﹣1H2SO4溶液与100mL 0.4molL﹣1的KOH溶液混合后,pH=_______.
(4)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣,下列分析结果肯定错误的是_____.
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(5)在25℃下,将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显_____(填“酸”“碱”或“中”)性;用含a的代数式表示NH3H2O的电离常数Kb=______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com