
����Ŀ����1��������ij��Һ����ˮ�����������Ũ�ȷ���c��H+��c��OH����=1��10��20����Һ����pHΪ____________����ʱˮ�ĵ����ܵ�______________��
��2����֪��2NO2��g��![]() N2O4��g����H=��57.20kJmol��1��һ���¶��£����ܱ������з�Ӧ2NO2��g��
N2O4��g����H=��57.20kJmol��1��һ���¶��£����ܱ������з�Ӧ2NO2��g��![]() N2O4��g���ﵽƽ�⣮������������ʱ�����д�ʩ�����NO2ת���ʵ���_____________������ĸ��
N2O4��g���ﵽƽ�⣮������������ʱ�����д�ʩ�����NO2ת���ʵ���_____________������ĸ��
A����СNO2��Ũ�� B�������¶� C������NO2��Ũ�� D�������¶�
��3����ij�¶��£�H2O�����ӻ�����Ϊ1��10��13 mol2L��2������¶��£�
��0.01molL��1NaOH��Һ��pH=__________��
��100mL 0.1molL��1H2SO4��Һ��100mL 0.4molL��1��KOH��Һ��Ϻ�pH=_______��
��4����֪һ��Һ��4�����ӣ�X+��Y����H+��OH�������з�������϶��������_____��
A��c��Y������c��X+����c��H+����c��OH����
B��c��X+����c��Y������c��OH������c��H+��
C��c��H+����c��Y������c��X+����c��OH����
D��c��OH������c��X+����c��H+����c��Y����
��5����25���£���a molL��1�İ�ˮ��0.01molL��1������������ϣ���Ӧʱ��Һ��c��NH4+��=c��Cl����������Һ��_____����ᡱ������С����ԣ��ú�a�Ĵ���ʽ��ʾNH3H2O�ĵ��볣��Kb=______________��
���𰸡� 4��10 ���� BC 11 12 C �� ![]()
����������1������pH�ļ����Ӱ��ˮ��������أ�������ˮ�����ӻ�Ϊ10��14>10��20��˵������Һ�������ᣬҲ�����Ǽ�������ᣬˮ�������c(H��)=c(OH��)������ʱ��Һ��c(H��)=Kw/c(OH��)=10��14/10��10mol��L��1=10��4mol��L��1����ʱ��Һ��pH=��lgc(H��)=4������Ϊ���ʱ��Һ��c(H��)=10��10mol��L��1����pH=10�������ỹ�Ǽ����ˮ�ĵ��룻��2��������������ԭ����A������NO2��Ũ�ȣ�ƽ�����淴Ӧ�����ƶ���NO2��ת���ʽ��ͣ���A����B���˷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ������У�NO2��ת��������B��ȷ��C������NO2��Ũ�ȣ��൱������ѹǿ��ƽ��������Ӧ������У�NO2��ת��������C��ȷ��D������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ������У���D����3������pH�ļ��㣬��0.01mol��L��1NaOH��Һ��c(OH��)=10��2mol��L��1������ˮ�����ӻ�������Һ��c(H��)=Kw/c(OH��)=10��13/10��2mol��L��1=10��11mol��L��1����pH=11����H2SO4��n(H��)=100��10��3��0.1��2mol=0.02mol��KOH��n(OH��)=100��10��3��0.4mol=0.04mol����Ȼ��Ӧ����Һ�Լ��ԣ���Ӧ��c(OH��)=![]() mol��L��1=0.1mol��L��1������ˮ�����ӻ������c(H��)=10��12mol��L��1����pH=12����4����������Ũ�ȴ�С��A���������Һ������ΪXY����������ǿ�������Σ�������Ũ�ȴ�С˳����c(Y��)>c(X��)>c(H��)c(OH��)����A˵����ȷ��B����������ΪXY������ǿ�������Σ�����Ũ�ȴ�С˳����c(X+)>c(Y��)>c(OH��)>c(H��)����B˵����ȷ��C������ѭ����غ㣬��C˵������D����c(OH��)>c(X��)������c(H��)>c(Y��������D˵����ȷ����5���������ƽ�ⳣ���ļ��㣬���ݵ���غ㣬��c(NH4��)��c(H��)=c(Cl��)��c(OH��)����c(NH4��)=c(Cl��)����c(H��)=c(OH��)����Һ�����ԣ�����ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��Һ�����ԣ���c(OH��)=10��7mol��L��1��c(NH4��)=c(Cl��)=0.01/2mol��L��1������NԪ���غ㣬��c(NH3��H2O)=(a/2��0.01/2)mol��L��1�����ݵ���ƽ�ⳣ���Ķ��壬Kb=
mol��L��1=0.1mol��L��1������ˮ�����ӻ������c(H��)=10��12mol��L��1����pH=12����4����������Ũ�ȴ�С��A���������Һ������ΪXY����������ǿ�������Σ�������Ũ�ȴ�С˳����c(Y��)>c(X��)>c(H��)c(OH��)����A˵����ȷ��B����������ΪXY������ǿ�������Σ�����Ũ�ȴ�С˳����c(X+)>c(Y��)>c(OH��)>c(H��)����B˵����ȷ��C������ѭ����غ㣬��C˵������D����c(OH��)>c(X��)������c(H��)>c(Y��������D˵����ȷ����5���������ƽ�ⳣ���ļ��㣬���ݵ���غ㣬��c(NH4��)��c(H��)=c(Cl��)��c(OH��)����c(NH4��)=c(Cl��)����c(H��)=c(OH��)����Һ�����ԣ�����ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��Һ�����ԣ���c(OH��)=10��7mol��L��1��c(NH4��)=c(Cl��)=0.01/2mol��L��1������NԪ���غ㣬��c(NH3��H2O)=(a/2��0.01/2)mol��L��1�����ݵ���ƽ�ⳣ���Ķ��壬Kb= ��������ֵ �����Kb=
��������ֵ �����Kb=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£����и���������ܴ�������������Ũ����������
A.NO��O2��N2B.HCl��H2��O2
C.NH3��O2��CO2D.CO2��H2S��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ת������Դ���úͻ�����������Ҫ�о����⡣
��1���ϳɰ���ҵ���������������֮һ�����ǻ��ʹ�ҵ�ͻ����л���������Ҫԭ�ϡ� �ϳɰ���Ӧ���йػ�ѧ�������������±���
��ѧ�� | H��H | N��N | N��H |
E/ kJmol��1 | 436 | 946 | 391 |
����֪���ϳɰ���Ӧ��N2(g)+3H2(g)![]() 2NH3(g)�Ļ��Ea=508 kJmol��1���ֽⷴӦ��2NH3(g)
2NH3(g)�Ļ��Ea=508 kJmol��1���ֽⷴӦ��2NH3(g)![]() N2(g)+3H2(g)�Ļ��Ea=_____��
N2(g)+3H2(g)�Ļ��Ea=_____��
����ͼ��ʾ500�桢60.0MPa�����£�ԭ����Ͷ�ϱ���ƽ��ʱNH3��������Ĺ�ϵ������ͼ��a�����ݼ���N2��ƽ�����������_____������3λ��Ч���֣���

�������¶ȶԺϳɰ���Ӧ��Ӱ�죬��ͼ����ϵ�У�����һ�������µ��ܱ������ڣ���ͨ��ԭ������ʼ�����¶Ȳ���������N2���ʵ����仯������ʾ��ͼ_______________��

��2��ѡ���Դ���ԭ��������(SCr)��Ŀǰ�ϳ�������������������ü�����ָ���¶�300~420��֮��ʹ��������£��û�ԭ��(��NH3)ѡ���Ե���NOx��Ӧ��
��SCr���������з�������Ҫ��ӦΪ��4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)��H=��1625.5kJ��mol��1��������[n(NH3)��n(NO)]��ֱ��Ӱ��÷����������ʡ�350��ʱ��ֻ�ı䰱����Ͷ������������ת�����백���ȵĹ�ϵ��ͼ��ʾ����n(NH3)��n(NO)��1.0ʱ��������NOŨ�ȷ���������Ҫԭ����_____��
4N2(g)+6H2O(g)��H=��1625.5kJ��mol��1��������[n(NH3)��n(NO)]��ֱ��Ӱ��÷����������ʡ�350��ʱ��ֻ�ı䰱����Ͷ������������ת�����백���ȵĹ�ϵ��ͼ��ʾ����n(NH3)��n(NO)��1.0ʱ��������NOŨ�ȷ���������Ҫԭ����_____��

��������Һ���������еĵ�������Ҳ��һ�������ķ�����д��NO2��Na2CO3��Һ�������������εĻ�ѧ��Ӧ����ʽ_____��
��ֱ�ӵ������Ҳ��������������6����ϡ��������NOx���������ᣬ�ٽ�����Һ������۵�⣬ʹ֮ת��Ϊ���ᡣ���װ����ͼ��ʾ�������ĵ缫��ӦʽΪ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ũҵ�о�����־�����������Ŀ�ѧ�ҷ��ְ��װ�������ǿ���̲�����Ⱦ�ߵ����������Կ��ư��̲�������������Ч����֪���װ���Ľṹ��ʽΪ![]() ��������˵��������ǣ�������
��������˵��������ǣ�������
A. �����Ӱ��װ�����ˮ�γɵĶ��Ľṹ��ʽΪ��![]()
B. ���װ�����һ����������
C. ![]() �������NaOH��Һ��Ӧ�ų�����
�������NaOH��Һ��Ӧ�ų�����
D. ��Ȼ������ˮ������Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ͭпԭ��أ���ͼ��ʾ����˵����ȷ����
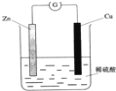
A. Zn�Ǹ�����������ԭ��Ӧ B. Cu�Ǹ���������������Ӧ
C. ͭƬ���������ݳ� D. ������ͭƬͨ����������пƬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ���л������ɰ�����·�ߺϳɣ�
���л������ɰ�����·�ߺϳɣ�
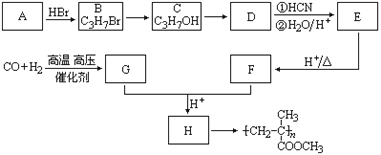
�����
��1��A��E�Ľṹ��ʽ�ֱ�Ϊ��___________________��______________________��
��2��B��C��E��F�ķ�Ӧ���ͷֱ�Ϊ��________________��________________��
��3��д������ת���Ļ�ѧ����ʽ��C��D___________________________________________��G+F��H___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ��д�����Mg2����Al3����H����Cl��������OH���������Һ����μ���0.5 mol��L��1NaOH��Һ�����ɳ����������ͼ���NaOH��Һ�����֮��Ĺ�ϵ����ͼ��ʾ������ж�ԭ��Һ��(����)
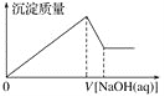
A. ��Mg2����û��Al3��
B. ��Al3����û��Mg2��
C. ��Mg2����Al3��
D. �����H����Mg2����Al3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������������̽��SO2�����ʡ�ʵ��ʱ��Na2SO3�����ϵμ���Ũ���ᣬ��������һ������������档
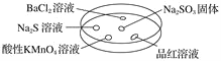
�±��ж�ʵ������������������Ľ��Ͳ���ȷ����(����)
ѡ�� | ʵ������ | ���� |
A | BaCl2��Һ����� | SO2��BaCl2��Һ��Ӧ������BaSO3���� |
B | Na2S��Һ����� | SO2��Na2S��Һ��Ӧ������S���� |
C | ����KMnO4��Һ��ɫ | SO2���л�ԭ�� |
D | Ʒ����Һ��ɫ | SO2����Ư���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾʵ��װ������֤���ȶ���Na2CO3ǿ��NaHCO3����ش�:
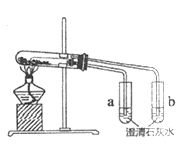
(1) NaHCO3���ȷֽ�Ļ�ѧ����ʽ��_________��
(2)֤�����ȶ���Na2CO3ǿ��NaHCO3��ʵ��������_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com