
ЎҫМвДҝЎҝПЦУРAЎўBЎўCЎўDЎўEЎўFБщЦЦіЈјы»ҜәПОпЈ¬ТСЦӘЛьГЗ°ьә¬өДСфАлЧУУРKЈ«ЎўAgЈ«ЎўNaЈ«ЎўBa2Ј«ЎўFe2Ј«ЎўAl3Ј«Ј¬ТхАлЧУУРClЈӯЎўOHЈӯЎўAlO2ЈӯЎўNO3ЈӯЎўSO42ЈӯЎўCO32ЈӯЎЈҪ«ЛьГЗ·ЦұрЕдіЙ0.1molЎӨLЈӯ1өДИЬТәҪшРРИзПВКөСйЈә
ўЩІвөГAЎўCЎўEИЬТәҫщіКјоРФЈ¬ЗТјоРФAЈҫEЈҫCЈ¬EөДСжЙ«іКЗіЧПЙ«ЈЁНё№эА¶Й«оЬІЈБ§№ЫІмЈ©Ј»ўЪПтBИЬТәЦРөОјУПЎ°ұЛ®ЦБ№эБҝЈ¬ПИЙъіЙіБөнЈ¬әуіБөнИ«ІҝИЬҪвЈ»ўЫПтFИЬТәЦРөОјУПЎПхЛбЈ¬ИЬТәұдіЙЧШ»ЖЙ«Ј¬ЗТУРОЮЙ«ЖшМеЙъіЙЈ»ўЬПтDИЬТәЦРөОјУBa(NO3)2ИЬТәЈ¬ОЮГчПФПЦПуЎЈ
ЈЁ1Ј©РҙіцAЎўDЎўEЎўFөД»ҜС§КҪЈәAЈ®________Ј»DЈ®________Ј»EЈ®_______Ј»FЈ®________ЎЈ
ЈЁ2Ј©УГАлЧУ·ҪіМКҪҪвКНCИЬТәіКјоРФөДФӯТтЈә____________________________________ЎЈ
ЈЁ3Ј©РҙіцКөСйўЫЦР·ҙУҰөДАлЧУ·ҪіМКҪЈә ___________________________________ЎЈ
Ўҫҙр°ёЎҝBa(OH)2AlCl3KAlO2FeSO4CO32ЈӯЈ«H2O![]() HCO3ЈӯЈ«OHЈӯ3Fe2Ј«Ј«NO3ЈӯЈ«4HЈ«===3Fe3Ј«Ј«NOЎьЈ«2H2O
HCO3ЈӯЈ«OHЈӯ3Fe2Ј«Ј«NO3ЈӯЈ«4HЈ«===3Fe3Ј«Ј«NOЎьЈ«2H2O
ЎҫҪвОцЎҝ
ёщҫЭИЬТәAЎўCЎўEіКјоРФЈ¬ЗТјоРФОӘAЈҫEЈҫCҝЙНЖЦӘAә¬УРOH-ЎўEә¬УРAlO2-ЎўCә¬УРCO32-Ј»ёщҫЭПтBИЬТәЦРөОјУПЎ°ұЛ®Ј¬ПИіцПЦіБөнЈ¬јМРшөОјУ°ұЛ®Ј¬іБөнПыК§ҝЙНЖЦӘИЬТәЦРә¬Ag+Ј»ёщҫЭПтFИЬТәЦРөОјУПЎПхЛбЈ¬ИЬТәұдіЙЧШ»ЖЙ«Ј¬ЗТУРОЮЙ«ЖшМеЙъіЙЈ¬ҝЙЦӘFә¬Fe2+Ј»ПтDИЬТәЦРөОјУBaЈЁNO3Ј©2ИЬТәЈ¬ОЮГчПФПЦПуЈ¬ЛөГчDИЬТәЦРОЮSO42-Ј¬УЙАлЧУ№ІҙжЦӘК¶ҝЙНЖЦӘABCDEFИЬТәТАҙООӘBaЈЁOHЈ©2ЎўAgNO3ЎўNa2CO3ЎўAlCl3ЎўKAlO2ЎўFeSO4ИЬТәЎЈ
ЈЁ1Ј©УЙ·ЦОцҝЙЦӘAОӘBaЈЁOHЈ©2Ј¬DОӘAlCl3Ј¬EОӘKAlO2Ј¬FОӘFeSO4Ј»ЈЁ2Ј©CОӘNa2CO3Ј¬Na2CO3ОӘЗҝјоИхЛбСОЈ¬ФЪИЬТәЦРЛ®ҪвК№ИЬТәіКјоРФЈ¬Л®ҪвөДАлЧУ·ҪіМКҪОӘЈәCO32-+H2O![]() HCO3-+OH-Ј»ЈЁ3Ј©КөСйўЫОӘСЗМъАлЧУУлПхЛбёщАлЧУФЪЛбРФМхјюПВ·ўЙъСх»Ҝ»№Фӯ·ҙУҰЙъіЙПхЛбМъЎўТ»Сх»ҜөӘәНЛ®Ј¬·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә3Fe2++NO3-+4H+=3Fe3++NOЎь+2H2OЎЈ
HCO3-+OH-Ј»ЈЁ3Ј©КөСйўЫОӘСЗМъАлЧУУлПхЛбёщАлЧУФЪЛбРФМхјюПВ·ўЙъСх»Ҝ»№Фӯ·ҙУҰЙъіЙПхЛбМъЎўТ»Сх»ҜөӘәНЛ®Ј¬·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә3Fe2++NO3-+4H+=3Fe3++NOЎь+2H2OЎЈ


 КАјН°ЩНЁЦчМеҝОМГРЎС§ҝОКұН¬ІҪҙпұкПөБРҙр°ё
КАјН°ЩНЁЦчМеҝОМГРЎС§ҝОКұН¬ІҪҙпұкПөБРҙр°ё КАјН°ЩНЁУЕБ·ІвПөБРҙр°ё
КАјН°ЩНЁУЕБ·ІвПөБРҙр°ё °Щ·ЦС§ЙъЧчТөұҫМвБ·НхПөБРҙр°ё
°Щ·ЦС§ЙъЧчТөұҫМвБ·НхПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөЪўсAЎўўчAЧеФӘЛШј°Жд»ҜәПОпФЪЙъ»оЎўЙъІъЦРУР№г·әУҰУГЎЈ»ШҙрПВБРОКМвЈә
(1)»щМ¬ДЖФӯЧУәЛНвөзЧУЕЕІјКҪОӘ___________ЎЈ
(2)H2·ЦЧУЦР№мөАЦШөю·ҪКҪКЗ___________ ( МоұкәЕ)ЎЈ
AЈ®s-s BЈ®s-p CЈ®p-p
(3)OF2ЎўO2F2КЗ·ъ»ҜОпЎЈOF2·ЦЧУөДЦРРДФӯЧУФУ»ҜАаРНКЗ___________ЎЈ
(4)ДЖЎўјШҫ§°ыИзНјAЛщКҫЈ¬Жд¶С»э·ҪКҪКЗ___________ЎЈ

(5)ВИ»ҜДЖҫ§°ыИзНјBЛщКҫ(°ЧЗтҙъұнCl-Ј¬әЪЗтҙъұнNa+)Ј¬ЖдЦРТхАлЧУөДЕдО»КэОӘ___________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝАыУГ·ПҫЙ¶ЖРҝМъЖӨЦЖұёҙЕРФFe3O4ҪәМеБЈЧУј°ёұІъОпZnOЈ¬ЦЖұёБчіМНјИзПВЈә
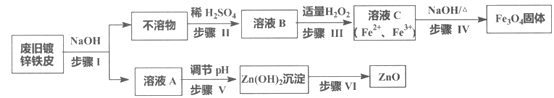
ТСЦӘ·ҙУҰЈәўЩZn+2NaOH=Na2ZnO2+H2Ўь ўЪZn(OH)2+2NaOH=Na2ZnO2+2H2O
»ШҙрПВБРОКМвЈә
(1)ІҪЦиIЦРөД·ЦАлІЩЧчГыіЖКЗ_______Ј¬ИЬТәAЦРөДИЬЦКУР_______(Мо»ҜС§КҪ)ЎЈ
(2)ІҪЦиIIIЦР·ҙУҰөДАлЧУ·ҪіМКҪКЗ___________________________________ЎЈ
(3)ІҪЦиIVЦР·ҙУҰөДАлЧУ·ҪіМКҪКЗ____________________________ЎЈ
(4)ІҪЦиVҝЙСЎУГөДКФјБКЗ_______(МоРтәЕ)ЎЈ
a. NaOHИЬТә b. °ұЛ® c. СОЛб
(5)ІҪЦиVIөДКөСйІЩЧчКЗ______________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР·ЦЧУЦРЈ¬ЦРРДФӯЧУКЗspФУ»ҜөДКЗ
A. BeCl2B. H2OC. CH4D. BF3
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЎ¶Мм№ӨҝӘОпЎ·ЦРјЗФШЈәИЛјъХЯ¶МәЦЎў– ЙСЈ¬¶¬ТФУщә®Ј¬ПДТФұОМеЈ¬ЖдЦКФмОпЦ®ЛщҫЯТІЎЈКфІЭДҫХЯЈ¬ОӘ– ЎўВйЎўЬЬЎўёрЈ¬КфЗЭКЮУлАҘіжХЯОӘфГәЦЎўЛҝГаЎЈёчФШЖд°лЈ¬¶шЙС·юідСЙТУЎЈОДЦРөДЎ°– ЎўВйЎўЬЬЎўёрЎұәНЎ°фГәЦЎўЛҝГаЎұ·ЦұрКфУЪ(ЎЎЎЎ)
A. ПЛО¬ЛШЎўУНЦ¬B. МЗАаЎўУНЦ¬
C. ПЛО¬ЛШЎўө°°ЧЦКD. өҘМЗЎўө°°ЧЦК
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөӘј°Жд»ҜәПОпөДЧӘ»ҜКЗЧКФҙАыУГәН»·ҫіұЈ»ӨөДЦШТӘСРҫҝҝОМвЎЈ
ЈЁ1Ј©әПіЙ°ұ№ӨТөКЗЧо»щұҫөДОЮ»ъ»Ҝ№ӨЦ®Т»Ј¬°ұКЗ»Ҝ·К№ӨТөәН»щұҫУР»ъ»Ҝ№ӨөДЦчТӘФӯБПЎЈ әПіЙ°ұ·ҙУҰЦРУР№Ш»ҜС§јьјьДЬКэҫЭИзПВұнЈә
»ҜС§јь | HЎӘH | NЎФN | NЎӘH |
E/ kJmol©Ғ1 | 436 | 946 | 391 |
ўЩТСЦӘЈәәПіЙ°ұ·ҙУҰЈәN2(g)+3H2(g)![]() 2NH3(g)өД»о»ҜДЬEa=508 kJmol©Ғ1Ј¬Фт°ұ·ЦҪв·ҙУҰЈә2NH3(g)
2NH3(g)өД»о»ҜДЬEa=508 kJmol©Ғ1Ј¬Фт°ұ·ЦҪв·ҙУҰЈә2NH3(g)![]() N2(g)+3H2(g)өД»о»ҜДЬEa=_____ЎЈ
N2(g)+3H2(g)өД»о»ҜДЬEa=_____ЎЈ
ўЪПВНјұнКҫ500ЎжЎў60.0MPaМхјюПВЈ¬ФӯБПЖшН¶БПұИУлЖҪәвКұNH3Ме»э·ЦКэөД№ШПөЎЈёщҫЭНјЦРaөгКэҫЭјЖЛгN2өДЖҪәвМе»э·ЦКэЈә_____ЈЁұЈБф3О»УРР§КэЧЦЈ©ЎЈ

ўЫТАҫЭОВ¶И¶ФәПіЙ°ұ·ҙУҰөДУ°ПмЈ¬ФЪНјЧшұкПөЦРЈ¬»ӯіцТ»¶ЁМхјюПВөДГЬұХИЭЖчДЪЈ¬ҙУНЁИлФӯБПЖшҝӘКјЈ¬ЛжОВ¶ИІ»¶ПЙэёЯЈ¬N2ОпЦКөДБҝұд»ҜөДЗъПЯКҫТвНј_______________ЎЈ

ЈЁ2Ј©СЎФсРФҙЯ»Ҝ»№ФӯНСПхјјКх(SCr)КЗДҝЗ°ҪПіЙКмөДСМЖшНСПхјјКхЈ¬ёГјјКхКЗЦёФЪОВ¶И300~420ЎжЦ®јдәНҙЯ»ҜјБМхјюПВЈ¬УГ»№ФӯјБ(ИзNH3)СЎФсРФөШУлNOx·ҙУҰЎЈ
ўЩSCrНСПхјјКхЦР·ўЙъөДЦчТӘ·ҙУҰОӘЈә4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)ЎчH=Јӯ1625.5kJЎӨmolЈӯ1Ј»°ұөӘұИ[n(NH3)ЈҜn(NO)]»бЦұҪУУ°ПмёГ·Ҫ·ЁөДНСПхВКЎЈ350ЎжКұЈ¬Ц»ёДұд°ұЖшөДН¶·ЕБҝЈ¬°ұЖшөДЧӘ»ҜВКУл°ұөӘұИөД№ШПөИзНјЛщКҫЎЈөұn(NH3)ЈҜn(NO)Јҫ1.0КұЈ¬СМЖшЦРNOЕЁ¶И·ҙ¶шФцҙуЈ¬ЦчТӘФӯТтКЗ_____ЎЈ
4N2(g)+6H2O(g)ЎчH=Јӯ1625.5kJЎӨmolЈӯ1Ј»°ұөӘұИ[n(NH3)ЈҜn(NO)]»бЦұҪУУ°ПмёГ·Ҫ·ЁөДНСПхВКЎЈ350ЎжКұЈ¬Ц»ёДұд°ұЖшөДН¶·ЕБҝЈ¬°ұЖшөДЧӘ»ҜВКУл°ұөӘұИөД№ШПөИзНјЛщКҫЎЈөұn(NH3)ЈҜn(NO)Јҫ1.0КұЈ¬СМЖшЦРNOЕЁ¶И·ҙ¶шФцҙуЈ¬ЦчТӘФӯТтКЗ_____ЎЈ

ўЪјоРФИЬТәҙҰАнСМЖшЦРөДөӘСх»ҜОпТІКЗТ»ЦЦНСПхөД·Ҫ·ЁЈ¬РҙіцNO2ұ»Na2CO3ИЬТәОьКХЙъіЙИэЦЦСОөД»ҜС§·ҙУҰ·ҪіМКҪ_____ЎЈ
ўЫЦұҪУөзҪвОьКХТІұ»УГУЪНСПхЎЈУГ6ЈҘөДПЎПхЛбОьКХNOxЙъіЙСЗПхЛбЈ¬ФЩҪ«ОьКХТәөјИлөзҪвІЫөзҪвЈ¬К№Ц®ЧӘ»ҜОӘПхЛбЎЈөзҪвЧ°ЦГИзНјЛщКҫЎЈСфј«өДөзј«·ҙУҰКҪОӘ_____ЎЈ

Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіТ»»Ҝ№Өі§ТФ·ПМъРјОӘФӯБПЦЖұёFeCl3ИЬТәЈ¬УГЧчУЎЛўөзВ·Нӯ°еёҜКҙјБЈ¬Іў¶ФИЬТәBҪшРРөзҪвҙҰАнөДКөСйБчіМИзНјЈә
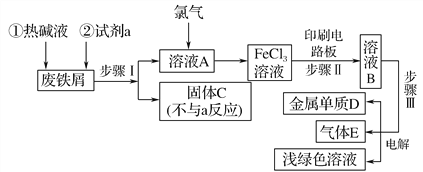
(1)КФјБaУҰСЎУГ________(МоРҙГыіЖ)Ј»
(2)ІҪЦиўсУГөҪөДЦчТӘІЈБ§ТЗЖчУРВ©¶·Ўў________(МоРҙТЗЖчГыіЖ)Ј»
(3)РҙіцІҪЦиўтЦРЦчТӘ·ҙУҰөД»ҜС§·ҪіМКҪ____________________Ј»
(4)КөСйКТЦЖИЎЖшМеEөДАлЧУ·ҪіМКҪКЗ________________________Ј¬Уы¶ФЖшМеEҪшРРёЙФпәНОьКХЈ¬РиСЎУГПВБРЧ°ЦГЦРөД________(МоРҙРтәЕ)Ј»
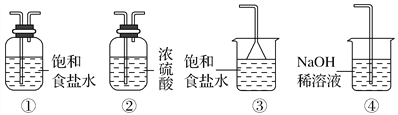
(5)ИзәОУГ»ҜС§·Ҫ·ЁјмСйЖшМеEЈҝ______________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР№ШУЪНӯРҝФӯөзіШЈЁИзНјЛщКҫЈ©өДЛө·ЁХэИ·өДКЗ
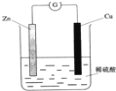
A. ZnКЗёәј«Ј¬·ўЙъ»№Фӯ·ҙУҰ B. CuКЗёәј«Ј¬·ўЙъСх»Ҝ·ҙУҰ
C. НӯЖ¬ЙПУРЖшМеТЭіц D. өзЧУУЙНӯЖ¬НЁ№эөјПЯБчПтРҝЖ¬
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЛжЧЕОТ№ъЖыіөДкПъБҝөДҙу·щФцјУЈ¬ёшҝХЖш»·ҫіФміЙБЛәЬҙуөДОЫИҫЎЈЖыіөОІЖшЧ°ЦГАпЈ¬ЖшМеФЪҙЯ»ҜјБұнГжОьёҪУлҪвОьЧчУГөД№эіМИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©

A. ·ҙУҰЦРNOОӘСх»ҜјБЈ¬N2ОӘСх»ҜІъОп
B. ЖыіөОІЖшөДЦчТӘОЫИҫіЙ·Ц°ьАЁCOЎўNOәНN2
C. NOәНO2ұШРлФЪҙЯ»ҜјБұнГжІЕДЬ·ҙУҰ
D. ҙЯ»ҜЧӘ»ҜЧЬ»ҜС§·ҪіМКҪОӘ2NOЈ«O2Ј«4CO ![]() 4CO2Ј«N2
4CO2Ј«N2
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com