
【题目】处理高浓度乙醛废水的新方法一隔膜电解法,让乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛一Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A. 若以CH4一空气燃料电池为直流电源,燃料电池的a极应通入甲烷
B. 电解过程中,阴极区Na2SO4的物质的量增大
C. 阳极反应为CH3CHO-2e-+H2O=CH3COOH+2H+
D. 阴极还原产物H2
【答案】C
【解析】
A.连接电解池阴极的是原电池负极,则a为正极,b为负极,负极上燃料失电子发生氧化反应,该燃料电池中燃料是甲烷,所以b电极上投放的是CH4,故A错误;B.钠离子和硫酸根离子不参与电极反应,物质的量不变,故B错误;C.阳极上发生氧化反应,其电极反应式为CH3CHO-2e-+H2O=CH3COOH+2H+,故C正确;D.阳极发生4OH--4e-═O2↑+2H2O、CH3CHO-2e-+H2O=CH3COOH+2H+,氢离子向阴极迁移,阴极发生4H++4e-=2H2↑、CH3CHO+2e-+2H+═CH3CH2OH,则两极除分别生成乙酸和乙醇外,均产生了无色气体,则阴极产生的是乙醇和H2,故D错误;故答案为C。


科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50mL 1 mol/L的AlCl3溶液中氯离子浓度相等的是
A. 150mL 3 mol/L的KClB. 75mL 2 mol/L的NH4Cl
C. 150mL 1 mol/L的NaClD. 75mL 2 mol/L的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如右图,关于其在各类反应中断裂键的说明不正确的是

A. 和金属钠反应键①断裂
B. 和HBr在一定条件下反应时键②断裂
C. 和浓硫酸共热140℃时键①或键②断裂;170℃时键②③断裂
D. 在Ag催化下和O2反应键①③断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L 1 mol·L-1的氨水中( )
A.含有1 mol NH3分子
B.含NH3和NH4+的物质的量之和为1 mol
C.含NH3·H2O、NH4+的物质的量之和为1 mol
D.含NH3、NH3·H2O、NH4+的物质的量之和为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图所示是分离混合物时常用的仪器,回答下列问题:

(1)写出仪器C、E的名称分别是_______________、______________。
(2)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体呈________色,下层液体呈______________色。
(3)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是_____________(填字母)。
A.汽油 B.CCl4 C.酒精 D.苯
Ⅱ.配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为_____mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用_____mL量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是________________。
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有水的烧杯中加入浓硫酸稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(5)下面操作造成所配稀硫酸溶液浓度偏高的是___________(填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以生产硼砂晶体的废渣为原料制取七水合硫酸镁的工艺流程如下:

资料:(1)生产硼砂晶体的废渣主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO:MnO、SiO2等杂质。
(2)滤渣C的成分为CaSO4·2H2O
回答下列问题:
(1)“酸浸”实验中,镁的浸出率结果如下图所示。由图可知,当镁的浸出率为80%时,所采用的实验条件为___________;

(2)滤渣B中含有不溶于稀盐酸、但能溶于热的浓盐酸的黑色固体,写出生成该黑色固体的离子方程式______________________;
(3)流程中加入的物质A是______________________;
(4)从滤液C中得到MgSO4·7H2O步骤为______________________;
(5)硼砂也可用于工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________;
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaHB4的有效氢含量为___________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。
例如,![]()
该反应式也可表示为
下面是几种有机化合物的转化关系:

(1)根据系统命名法,化合物A的名称是_____________。
(2)反应①的反应类型_________,反应③的反应类型___________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______。
(4)C2的结构简式是______________,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,按图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是 ( )
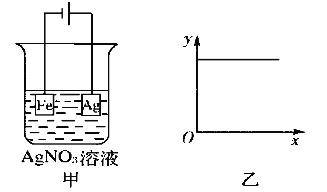
A. c(Ag+) B. c(NO)
C. 溶液氢离子浓度 D. 阴极质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关13C、15N的叙述正确的是( )
A. 13C与15N有相同的中子数B. C60与13C互为同素异形体
C. 15N与14N互为同位素D. 15N的核外电子数与中子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com