
【题目】以生产硼砂晶体的废渣为原料制取七水合硫酸镁的工艺流程如下:

资料:(1)生产硼砂晶体的废渣主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO:MnO、SiO2等杂质。
(2)滤渣C的成分为CaSO4·2H2O
回答下列问题:
(1)“酸浸”实验中,镁的浸出率结果如下图所示。由图可知,当镁的浸出率为80%时,所采用的实验条件为___________;

(2)滤渣B中含有不溶于稀盐酸、但能溶于热的浓盐酸的黑色固体,写出生成该黑色固体的离子方程式______________________;
(3)流程中加入的物质A是______________________;
(4)从滤液C中得到MgSO4·7H2O步骤为______________________;
(5)硼砂也可用于工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________;
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaHB4的有效氢含量为___________(保留两位小数)。
【答案】100℃、2.8h左右 ClO-+Mn2++H2O=MnO2↓+ClO-+2H+ MgO(或Ca(OH)2、CaCO3等合理答案均可) 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 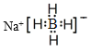 0.21
0.21
【解析】
分析流程,硼镁泥中主要有MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质,通过硫酸酸浸,得到滤渣为SiO2,滤液中含有Na+、Ca2+、Fe2+、Fe3+、Mn2+、H+、SO42-、B4O72-,经过NaClO溶液处理,NaClO在酸性溶液中具有一定的氧化性,将Fe2+氧化为Fe3+,将Mn2+氧化为MnO2,加入MgO处理,形成Fe(OH)3和MnO2,这就是滤渣B,滤液经过蒸发浓缩,趁热过滤,得到滤渣C为CaSO42H2O,此时滤液中存在Na+、B4O72-、SO42-、Mg2+,滤液经过冷却结晶,得到MgSO47H2O和硼砂溶液,据此分析;
(5)①NaBH4的电子式,存在Na+和BH4-,据此写出电子式;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,结合电子得失守恒计算;
(1) 由图可知,当铁的浸出率为80%时,所采用的实验条件为选择温度为100℃、2.8h左右;
(2) 滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,根据流程分析,应为MnO2,由NaClO在酸性溶液中氧化Mn2+得到,考虑到介质为酸性,H+参与反应或反应生成H+,则生成黑色固体的离子方程式为:ClO-+Mn2++H2O═MnO2+Cl-+2H+;
(3)流程中加入物质A的目的是中和溶液的H+,促进溶液中的Fe3+水解生成Fe(OH)3沉淀,结合不引入新的杂质的前提下,A应选择MgO(或Ca(OH)2、CaCO3等);
(4)将滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,最终获得MgSO4·7H2O晶体;
(5)①NaBH4为离子化合物,含有Na+和BH4-,则NaBH4的电子式为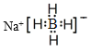 ;
;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,1gH2的物质的量为![]() =0.5mol,0.5molH2转移的电子数为1mol,根据电子得失守恒,NaBH4也应转移1mol电子,NaBH4中H为-1价,做还原剂时,H从-1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则转移1mol电子消耗NaBH4的物质的量为0.125mol,其质量为0.125mol×38g/mol=4.75g,即1gH2相当于4.75gNaBH4,那么1gNaBH4相当于
=0.5mol,0.5molH2转移的电子数为1mol,根据电子得失守恒,NaBH4也应转移1mol电子,NaBH4中H为-1价,做还原剂时,H从-1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则转移1mol电子消耗NaBH4的物质的量为0.125mol,其质量为0.125mol×38g/mol=4.75g,即1gH2相当于4.75gNaBH4,那么1gNaBH4相当于![]() gH2,即0.21gH2,故答案为:0.21。
gH2,即0.21gH2,故答案为:0.21。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法中正确的是

①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应。
A. ②③ B. ①②④ C. ①③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于现有元素周期表的叙述正确的是( )
A. 共有 6 个周期,16 个族 B. 共有 7 个周期,18 个族
C. 共有 6 个周期,18 个族 D. 共有 7 个周期,16 个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理高浓度乙醛废水的新方法一隔膜电解法,让乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛一Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A. 若以CH4一空气燃料电池为直流电源,燃料电池的a极应通入甲烷
B. 电解过程中,阴极区Na2SO4的物质的量增大
C. 阳极反应为CH3CHO-2e-+H2O=CH3COOH+2H+
D. 阴极还原产物H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列有关说法错误的是( )
A. 高纯单质硅用于制光电池B. 酸雨是指pH<5.6的雨水
C. 二氧化硫和二氧化碳可用澄清石灰水鉴别D. 浓硫酸能使纸张变黑,是因为其具有脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体是一种常见的分散系,回答下列问题。
(1)向煮沸的蒸馏水中逐滴加入____________溶液,继续煮沸至__________________,停止加热,可制得Fe(OH)3胶体。
(2)向Fe(OH)3胶体中加入Na2SO4饱和溶液,主要由于________(填离子符号)的作用,使胶体形成了沉淀,这个过程叫作________________。
(3)区分胶体和溶液常用的方法叫作______________,这是因为胶体粒子对光线的________作用而形成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C![]() 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. a的值为3
C. 反应后有两种氧化产物 D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。实验药品:铜、铁、镁、0.5 mol L-1H2SO4溶液、2 mol L-1 H2SO4溶液。甲同学研究的实验报告如下表∶
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol L-1 的硫酸溶液于三支试管中 | 反应速率∶ 镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1) 甲同学表中实验步骤②为______________________。
(2) 甲同学的实验目的是__________________________。
要得出正确的实验结论,还需要控制的实验条件是_____________。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行实验∶

(3)乙同学在实验中应该测定的数据是_________________。
(4)乙同学完成该实验应选用的实验药品是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com