
【题目】胶体是一种常见的分散系,回答下列问题。
(1)向煮沸的蒸馏水中逐滴加入____________溶液,继续煮沸至__________________,停止加热,可制得Fe(OH)3胶体。
(2)向Fe(OH)3胶体中加入Na2SO4饱和溶液,主要由于________(填离子符号)的作用,使胶体形成了沉淀,这个过程叫作________________。
(3)区分胶体和溶液常用的方法叫作______________,这是因为胶体粒子对光线的________作用而形成的
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,碳原子的杂化轨道类型为_________。


(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为_______。
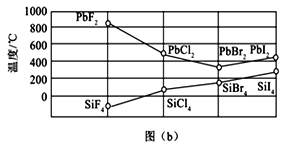
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
SiX4的沸点依F、Cl、Br、I次序升高的原因是:______________________________________。
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为___________________________________g·cm-3(列式并计算保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L 1 mol·L-1的氨水中( )
A.含有1 mol NH3分子
B.含NH3和NH4+的物质的量之和为1 mol
C.含NH3·H2O、NH4+的物质的量之和为1 mol
D.含NH3、NH3·H2O、NH4+的物质的量之和为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以生产硼砂晶体的废渣为原料制取七水合硫酸镁的工艺流程如下:

资料:(1)生产硼砂晶体的废渣主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO:MnO、SiO2等杂质。
(2)滤渣C的成分为CaSO4·2H2O
回答下列问题:
(1)“酸浸”实验中,镁的浸出率结果如下图所示。由图可知,当镁的浸出率为80%时,所采用的实验条件为___________;

(2)滤渣B中含有不溶于稀盐酸、但能溶于热的浓盐酸的黑色固体,写出生成该黑色固体的离子方程式______________________;
(3)流程中加入的物质A是______________________;
(4)从滤液C中得到MgSO4·7H2O步骤为______________________;
(5)硼砂也可用于工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________;
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaHB4的有效氢含量为___________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。
例如,![]()
该反应式也可表示为
下面是几种有机化合物的转化关系:

(1)根据系统命名法,化合物A的名称是_____________。
(2)反应①的反应类型_________,反应③的反应类型___________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______。
(4)C2的结构简式是______________,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小
B. 一定温度下,反应“2HI(g)![]() H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
C. 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性
D. 上图电池放电时的正极反应式:2Li++Li2O2+2e—=2Li2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,按图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是 ( )
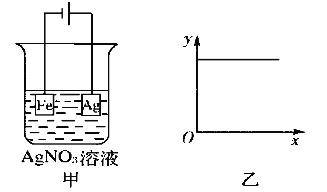
A. c(Ag+) B. c(NO)
C. 溶液氢离子浓度 D. 阴极质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应:3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是

A. 若t1=15s, A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.09 mol·L-1·s-1
B. t0~t1阶段,此过程中容器放出a kJ热量,该反应的热化学方程式为:3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
C. 该容器的容积为2 L,B的起始的物质的量为0.03 mol
D. t1时该反应达到平衡且A 的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 | H2SO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(1)25℃时,将20mL 0.1mol·L-1CH3COOH溶液和20mL 0.1mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:__________________________
(2)若保持温度不变,在CH3COOH溶液中加入一定量氨气,下列量会变小的是____(填序号)
A.c(CH3COO-) B.c(H+)C.Kw D.醋酸电离平衡常数
(3)若保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,此时c(Cl-)_____c(SCN-) (填“>、=、<”,后同),两溶液的导电性:HCl _______HSCN
(4)将足量的NaHSO3溶液加入Na2CO3溶液中,反应的离子方程式为___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com