
ЎҫМвДҝЎҝФЪ80ЎжКұЈ¬Ҫ«0.4molөДЛДСх»Ҝ¶юөӘЖшМеідИл2LТСійҝХөД№М¶ЁИЭ»эөДГЬұХИЭЖчЦРЈ¬ёфТ»¶ОКұјд¶ФёГИЭЖчДЪөДОпЦКҪшРР·ЦОцЈ¬өГөҪИзПВКэҫЭЈә
c(molЎӨL-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | C | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
·ҙУҰҪшРРЦБ100sәуҪ«·ҙУҰ»мәПОпөДОВ¶ИҪөөНЈ¬·ўПЦЖшМеөДСХЙ«ұдЗіЎЈ
ЈЁ1Ј©ёГ·ҙУҰөД»ҜС§·ҪіМКҪОӘ________________________________ЎЈ
ЈЁ2Ј©20sКұЈ¬N2O4өДөДЕЁ¶ИОӘ__________molЎӨL-1Ј¬0Ў«20sДЪN2O4өДЖҪҫщ·ҙУҰЛЩВКОӘ_____________ЎЈ
ЈЁ3Ј©ёГ·ҙУҰөДЖҪәвіЈКэұнҙпКҪK=____________Ј¬80Ўж·ҙУҰKЦөОӘ___________ұЈБф2О»РЎКэ)ЎЈ
ЈЁ4Ј©ФЪЖдЛыМхјюПаН¬КұЈ¬ёГ·ҙУҰөДKЦөФҪҙуЈ¬ұнГчҪЁБўЖҪәвКұ______________ЎЈ
AЈ®N2O4өДЧӘ»ҜВКФҪёЯ BЈ®NO2өДІъБҝФҪҙу
CЈ®N2O4УлNO2өДЕЁ¶ИЦ®ұИФҪҙу DЈ®Хэ·ҙУҰҪшРРөДіМ¶ИФҪҙу
ЈЁ5Ј©ТӘФцҙуёГ·ҙУҰөДKЦөЈ¬ҝЙІЙИЎөДҙлК©_________
AЈ®ФцҙуN2O4ЖрКјЕЁ¶И BЈ®Пт»мәПЖшЦРНЁИлNO2
CЈ®К№УГёЯР§ҙЯ»ҜјБ DЈ®ЙэёЯОВ¶И
ЈЁ6Ј©ПВНјКЗ80ЎжКұИЭЖчЦРN2O4ЕЁ¶ИөДұд»ҜНјЈ¬ЗлФЪёГНјЦРІ№»ӯіцёГ·ҙУҰФЪ60Ўж·ҙУҰКұN2O4ЕЁ¶ИөДұд»ҜЗъПЯ_______ЎЈ

Ўҫҙр°ёЎҝ N2O4![]() 2NO2 0.14 0.003 mol/(LЎӨs)
2NO2 0.14 0.003 mol/(LЎӨs) 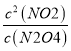 0.54 ABD D
0.54 ABD D 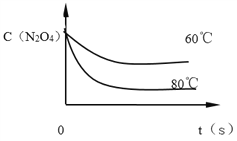
ЎҫҪвОцЎҝЈЁ1Ј©ёГ·ҙУҰөД»ҜС§·ҪіМКҪОӘЈәN2O4![]() 2NO2Ј»ЈЁ2Ј©ҪшРРөҪ20SЈ»
2NO2Ј»ЈЁ2Ј©ҪшРРөҪ20SЈ»
N2O4![]() 2NO2
2NO2
ЖрКјБҝЈЁmolЈ© 0.4 0
ұд»ҜБҝЈЁmolЈ© 0.12 0.24
20sД©ЈЁmolЈ© 0.28 0.24
20sКұЈ¬N2O4өДЕЁ¶И=![]() =0.14mol/LЈ»
=0.14mol/LЈ»
0Ў«20sДЪN2O4өДЖҪҫщ·ҙУҰЛЩВК=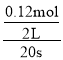 =0.003mol/(Ls)Ј»
=0.003mol/(Ls)Ј»
ЈЁ3Ј©N2O4![]() 2NO2Ј¬ЖҪәвіЈКэK=
2NO2Ј¬ЖҪәвіЈКэK=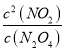 Ј»
Ј»
80ЎгCЖҪәвЧҙМ¬әН60SКЗПаН¬ЖҪәвЧҙМ¬Ј¬ЖҪәвЕЁ¶ИcЈЁNO2Ј©=0.22mol/LЈ¬cЈЁN2O4Ј©=0.09mol/LЈ»
ЖҪәвіЈКэK=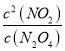 =
=![]() =0.54mol/LЈ»
=0.54mol/LЈ»
ЈЁ4Ј©·ҙУҰҪшРРЦБ100sәуҪ«·ҙУҰ»мәПОпөДОВ¶ИҪөөНЈ¬·ўПЦЖшМеөДСХЙ«ұдЗіЈ¬ЛөГч·ҙУҰПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬Дж·ҙУҰКЗ·ЕИИ·ҙУҰЈ¬Хэ·ҙУҰКЗОьИИ·ҙУҰЈ»ёГ·ҙУҰөДKЦөФҪҙуЈ¬ЛөГчЖҪәвХэПтҪшРРЈ¬КЗОВ¶ИҪөөНөДФӯТтЈ»AЎўЖҪәвХэПтҪшРРN2O4өДЧӘ»ҜВКФҪёЯЈ¬СЎПоAХэИ·Ј»BЎўЖҪәвХэПтҪшРРNO2өДІъБҝФҪҙуЈ¬СЎПоBХэИ·Ј»CЎўТАҫЭЙПКцјЖЛг·ЦОцЖҪәвХэПтҪшРРЈ¬N2O4УлNO2өДЕЁ¶ИЦ®ұИФҪРЎЈ¬СЎПоCҙнОуЈ»DЎўёГ·ҙУҰөДKЦөФҪҙуЈ¬ЛөГчЖҪәвХэПтҪшРРЈ¬Хэ·ҙУҰҪшРРөДіМ¶ИФҪҙуЈ¬СЎПоDХэИ·ЎЈҙр°ёСЎABDЈ»ЈЁ5Ј©ЖҪәвіЈКэЦ»КЬОВ¶ИУ°ПмЈ¬ТӘФцҙуёГ·ҙУҰөДKЦөЈ¬УҰёДұдОВ¶ИК№ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ёГ·ҙУҰХэ·ҙУҰКЗОьИИ·ҙУҰЈ¬№КУҰЙэёЯОВ¶ИЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ЖҪәвіЈКэKФцҙуЈ¬ҙр°ёСЎDЈ»ЈЁ6Ј©ОВ¶ИҪөөНЈ¬»ҜС§·ҙУҰЛЩВКјхВэЈ¬өҪҙпЖҪәвөДКұјдіӨЈ¬Н¬КұЈ¬ОВ¶ИҪөөНЈ¬»ҜС§ЖҪәвПт·ЕИИөД·ҪПтТЖ¶ҜЈ¬јҙДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬ИзПВНјЈә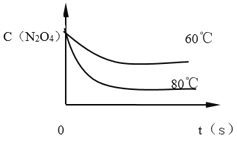 ЎЈ
ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ2016ДкЕөұҙ¶ы»ҜС§ҪұУЙ·Ё№ъЎўГА№ъј°әЙАјөДИэО»»ҜС§јТ·Ц»сЈ¬ТФұнХГЛыГЗФЪЎ°·ЦЧУВнҙпЎұСРҫҝ·ҪГжөДіЙҫНЈ¬Т»ЦЦ№вЗэ·ЦЧУВнҙпҪб№№ИзНјЛщКҫЎЈУР№ШёГ·ЦЧУөДЛө·ЁХэИ·өДКЗ

A. ёГ·ЦЧУКфУЪ·јПгМю
B. БҪёцұҪ»·ҝЙТФҙҰУЪН¬Т»ЖҪГж
C. ДЬУлNaHCO3әНЛбРФKMnO4ИЬТә·ҙУҰ
D. 1molёГ·ЦЧУЧо¶аҝЙУл2molH2·ўЙъјУіЙ·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРКВКөІ»ДЬУГАХПДМШБРФӯАнҪвКНөДКЗ
A. ¶ФУЪ2HI(g)![]() H2(g)+I2(g)Ј¬ҙпЖҪәвәуЈ¬ЛхРЎИЭЖчМе»эҝЙК№МеПөСХЙ«ұдЙо
H2(g)+I2(g)Ј¬ҙпЖҪәвәуЈ¬ЛхРЎИЭЖчМе»эҝЙК№МеПөСХЙ«ұдЙо
B. деЛ®ЦРУРПВБРЖҪәвBr2+H2O![]() HBr+HBrOЈ¬өұјУИлПхЛбТшИЬТәәуЈ¬ИЬТәСХЙ«ұдЗі
HBr+HBrOЈ¬өұјУИлПхЛбТшИЬТәәуЈ¬ИЬТәСХЙ«ұдЗі
C. әПіЙ°ұ·ҙУҰЈ¬ОӘМбёЯ°ұөДІъВКЈ¬АнВЫЙПУҰІЙИЎҪөөНОВ¶ИөДҙлК©
D. ·ҙУҰCO(g)+NO2(g)![]() CO2(g)+NO(gЈ© ЎчHЈј0Ј¬ҙпЖҪәвәуЈ¬ЙэёЯОВ¶ИМеПөСХЙ«ұдЙо
CO2(g)+NO(gЈ© ЎчHЈј0Ј¬ҙпЖҪәвәуЈ¬ЙэёЯОВ¶ИМеПөСХЙ«ұдЙо
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРОпЦКЦРІ»КфУЪөзҪвЦКөДКЗЈЁ Ј©
A.ПхЛбјШB.ПЎБтЛбC.ВИ»ҜДЖҫ§МеD.ЗвСх»ҜДЖ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР№ШУЪЛө·ЁХэИ·өДКЗ
A. HClәНNaOH·ҙУҰөДЦРәНИИОӘ57.3kJ/molЈ¬H2SO3әНNaOH·ҙУҰөДЦРәНИИТІОӘ57.3kJ/mol
B. ТСЦӘC2H5OHЈЁlЈ©өДИјЙХИИКЗ1366.8kJ/molЈ¬ФтC2H5OHЈЁlЈ©+3O2ЈЁgЈ©ЁT2CO2ЈЁgЈ©+3H2OЈЁgЈ©·ҙУҰөДЎчH=©Ғ1366.8kJ/mol
C. ФЪТ»¶ЁОВ¶ИәНС№ЗҝПВЈ¬Ҫ«0.5mol N2әН1.5mol H2ЦГУЪГЬұХИЭЖчЦРід·Ц·ҙУҰЙъіЙNH3ЈЁgЈ©Ј¬·ЕіцИИБҝ19.3kJЈ¬ФтЖдИИ»ҜС§·ҪіМКҪОӘN2(g)+3H2(g)![]() 2NH3(g) ЎчH=©Ғ38.6kJ/mol
2NH3(g) ЎчH=©Ғ38.6kJ/mol
D. Т»¶ЁМхјюПВ2SO2(g)+O2(g)2SO3(g) ЎчH1 Ј¬2SO2(g)+O2(g)2SO3(l) ЎчH2 ФтЎчH1ЈҫЎчH2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі·ПҙЯ»ҜјБә¬58Ј®2ЈҘөДSiO2Ўў21Ј®0ЈҘөДZnOЎў4Ј®5ЈҘөДZnSәН12Ј®8ЈҘөДCuSЈ¬ДіН¬С§ТФёГ·ПҙЯ»ҜјБОӘФӯБПЈ¬»ШКХЖдЦРөДРҝәННӯЎЈІЙУГөДКөСй·Ҫ°ёИзПВЈә

ТСЦӘЈә1Ј®ІҪЦиўЩЦР·ўЙъөД»ҜС§·ҙУҰОӘ·ЗСх»Ҝ»№Фӯ·ҙУҰ 2Ј®ВЛФь2өДЦчТӘіЙ·ЦКЗSiO2әНSЈ¬ПВБРЛө·ЁІ»ХэИ·өДКЗ
A. ІҪЦиўЩЈ¬ЧоәГФЪНЁ·зічЦРҪшРР
B. ІҪЦиўЩәНўЫЈ¬ЛөГчCuSІ»ИЬУЪПЎБтЛб¶шZnSИЬУЪПЎБтЛб
C. ІҪЦиўЫЈ¬Йжј°өДАлЧУ·ҙУҰОӘCuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. ІҪЦиўЪәНўЬЈ¬ҫщІЙУГХф·ўҪбҫ§өД·ҪКҪ»сИЎИЬЦК
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПт50 mLПЎH2SO4УлПЎHNO3өД»мәПИЬТәЦРЦрҪҘјУИлМъ·ЫЈ¬јЩЙијУИлМъ·ЫөДЦКБҝУлІъЙъЖшМеөДМе»э(ұкЧјЧҙҝц)Ц®јдөД№ШПөИзПВНјЛщКҫЈ¬ЗТГҝТ»¶ОЦ»¶ФУҰТ»ёц·ҙУҰЎЈПВБРЛө·ЁХэИ·өД

A. ҝӘКјКұІъЙъөДЖшМеОӘH2
B. AB¶ОІъЙъөД·ҙУҰОӘЦГ»»·ҙУҰ
C. ЛщУГ»мәПИЬТәЦРc(HNO3)ЈҪ0.5molЎӨLЈӯ1
D. ІОјУ·ҙУҰМъ·ЫөДЧЬЦКБҝm2ЈҪ5.6 g
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРОпЦККфУЪөзҪвЦКөДТ»ЧйКЗ( )
A.CO2ЎўNH3ЎўHCl
B.H2SO4ЎўHNO3ЎўBaCl2
C.H3PO4ЎўH2OЎўCu
D.ТәМ¬KNO3ЎўNaOHИЬТәЎўCH3COOH
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДҝЗ°№ӨТөЙПҝЙАыУГCO»тCO2АҙЙъІъИјБПјЧҙјЈ¬ДіСРҫҝРЎЧй¶ФПВБРУР№ШјЧҙјЦЖИЎөДИэМх»ҜС§·ҙУҰФӯАнҪшРРМҪҫҝЎЈТСЦӘФЪІ»Н¬ОВ¶ИПВөД»ҜС§·ҙУҰЖҪәвіЈКэ(K1ЎўK2ЎўK3)ИзПВұнЛщКҫЈә
»ҜС§·ҙУҰ | мКұд | ЖҪәвіЈКэ | ОВ¶И/Ўж | ||
500 | 700 | 800 | |||
ўЩ2H2(g)Ј«CO(g) | ҰӨH1 | K1 | 2.5 | 0.34 | 0.15 |
ўЪCO2(g)Ј«H2(g) | ҰӨH2 | K2 | 1.0 | 1.70 | 2.52 |
ўЫCO2(g)Ј«3H2(g) | ҰӨH3 | K3 | |||
Зл»ШҙрПВБРОКМвЈә
(1)·ҙУҰўЪКЗ________(МоЎ°ОьИИЎұ»тЎ°·ЕИИЎұ)·ҙУҰЎЈ
(2)ёщҫЭ·ҙУҰўЩУлўЪҝЙНЖөјіцK1ЎўK2УлK3Ц®јдөД№ШПөЈ¬ФтK3ЈҪ________(УГK1ЎўK2ұнКҫ)Ј»ёщҫЭ·ҙУҰўЫЕР¶ПҰӨS___0(МоЎ°>ЎұЎўЎ°ЈҪЎұ»тЎ°<Ўұ)Ј¬ФЪ______(МоЎ°ҪПёЯЎұ»тЎ°ҪПөНЎұ)ОВ¶ИПВУРАыУЪёГ·ҙУҰЧФ·ўҪшРРЎЈ
(3)500ЎжКұЈ¬ІвөГ·ҙУҰўЫФЪДіКұҝМЈ¬CO2(g)ЎўH2(g)ЎўCH3OH(g)ЎўH2O(g)өДЕЁ¶И·ЦұрОӘ0.1mol/LЎў0.8mol/LЎў0.3mol/LЎў0.15mol/L
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com