
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)写出NaCN的电子式____________,CN-中C元素显+2价,N元素显-3价,则非金属性N_______C(填“<”“>”或“==”)(1分),请设计实验证明:__________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________________________________________。
Ⅱ.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物无沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。实验室通过如下图所示装置制备Na2S2O3。
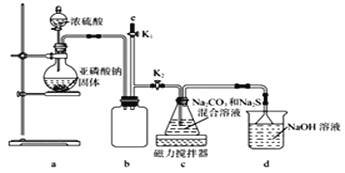
(1)实验中要控制SO2生成速率,可采取的措施有____________________ (写出一条)。
(2)b装置的作用是____________________________。
(3)反应开始后,c中先有淡黄色浑浊产生后又变为澄清,此浑浊物______(填化学式)。
(4)实验结束后,在e处最好连接盛______ (填“NaOH溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______,最后拆除装置。
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________。若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
【答案】![]() > 取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生。说明酸性硝酸大于碳酸,则非金属性N>C CN-+H2O2+H2O=HCO3-+NH3↑ 控制反应温度、调节酸的滴加速度或调节酸的浓度等 安全瓶,防止倒吸 S NaOH溶液 关闭K2打开K1 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸
> 取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生。说明酸性硝酸大于碳酸,则非金属性N>C CN-+H2O2+H2O=HCO3-+NH3↑ 控制反应温度、调节酸的滴加速度或调节酸的浓度等 安全瓶,防止倒吸 S NaOH溶液 关闭K2打开K1 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸
【解析】
I.(1)在化合物中非金属性强的元素显负价,非金属性弱的元素显正价。
(2)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气。
Ⅱ.(1)实验中要控制SO2生成速率,可采取的措施有:控制反应温度、调节酸的滴加速度或调节酸的浓度等。
(2)由仪器结构特征,可知b装置为安全瓶,防止倒吸。
(3)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3。
(4)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收。
(5)根据: Na2S2O3是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成; Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl,BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知。
I.(1)NaCN的电子式:![]() ,在化合物中非金属性强的元素显负价,非金属性弱的元素显正价,CN-中C元素显 +2价,N元素显-3价,则非金属性 N> C,元素的非金属性越强,对应的最高价氧化物的水化物酸性越强,设计实验为取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生。说明酸性硝酸大于碳酸,则非金属性N>C。故答案为:
,在化合物中非金属性强的元素显负价,非金属性弱的元素显正价,CN-中C元素显 +2价,N元素显-3价,则非金属性 N> C,元素的非金属性越强,对应的最高价氧化物的水化物酸性越强,设计实验为取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生。说明酸性硝酸大于碳酸,则非金属性N>C。故答案为:![]() ;>;取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生。说明酸性硝酸大于碳酸,则非金属性N>C。
;>;取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生。说明酸性硝酸大于碳酸,则非金属性N>C。
(2)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O=NaHCO3+NH3↑,离子反应为:CN-+H2O2+H2O=HCO3-+NH3↑ ,故答案为:CN-+H2O2+H2O=HCO3-+NH3↑ 。
Ⅱ.(1)实验中要控制SO2生成速率,可采取的措施有:控制反应温度、调节酸的滴加速度或调节酸的浓度等,故答案为:控制反应温度、调节酸的滴加速度或调节酸的浓度。
(2)由仪器结构特征,可知b装置为安全瓶,防止倒吸,故答案为:安全瓶,防止倒吸。
(3)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3,c中先有浑浊产生,后又变澄清,此浑浊物为S,故答案为: S 。
(4)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,再关闭K2打开K1 ,防止拆除装置时污染空气,故答案为: NaOH 溶液;关闭K2打开K1。
(5)根据: Na2S2O3是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成; Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl,BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下某种O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
A. (Vmnb)/(mNA ) B. (Vm mb)/(nNA ) C. (VmnNA)/mb D. (nbNA)/(Vm m)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年2月19日在第十三届阿布扎比国际防务展上,采用先进的氢燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录。下列有关氢燃料电池的说法不正确的是
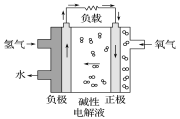
A. 通入氢气的电极发生氧化反应
B. 碱性电解液中阳离子向通入氢气的方向移动
C. 正极的电极反应式为O2+2H2O+4e-===4OH-
D. 放电过程中碱性电解液的OH-的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某浓度的硝酸与金属锌反应,生成NO2和NO的物质的量之比为1︰3。则要使1mol金属锌完全反应,需要HNO3的物质的量为
A. 0.8 B. 2.4 C. 2.6 D. 2.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.稀有气体原子的最外层电子数都是8
B.元素周期表有十八个纵行,分为十八个族
C.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
D.知道元素的周期序数,就能确定该元素在周期表中的位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO、SiO2等氧化物杂质)制取金属锌的流程如图所示。回答下列问题:

(1)ZnFe2O4中Fe的化合价为______价,已知ZnFe2O4能溶于酸,则酸浸时ZnFe2O4反应的离子方程式为_________________________,酸浸后滤渣的成分主要是__________。
(2)酸浸时一般要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可以采用的方法是___________________(任答一条即可)
(3)净化Ⅰ中H2O2参与反应的离子方程式为_________________________________,试剂X的作用是_______________,
(4)净化Ⅱ中得到的Y是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com