
【题目】下列说法中正确的是
A.稀有气体原子的最外层电子数都是8
B.元素周期表有十八个纵行,分为十八个族
C.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
D.知道元素的周期序数,就能确定该元素在周期表中的位置
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】由铁、铜和稀硫酸组成的原电池,所发生的总反应的离子方程式是
A. Fe-2e-=Fe2+ B. Cu2++2e-=Cu
C. 2H++2e-=H2↑ D. Fe+2H+=Fe2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2和O2反应生成2molSO3时,放出的热量为QkJ,在1L的密闭容器中进行反应2SO2(g)+O2(g)![]() 2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是( )
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是( )
A. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
B. 反应达到平衡时放出的热量为0.1QkJ
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)写出NaCN的电子式____________,CN-中C元素显+2价,N元素显-3价,则非金属性N_______C(填“<”“>”或“==”)(1分),请设计实验证明:__________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________________________________________。
Ⅱ.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物无沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。实验室通过如下图所示装置制备Na2S2O3。
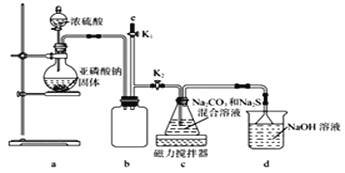
(1)实验中要控制SO2生成速率,可采取的措施有____________________ (写出一条)。
(2)b装置的作用是____________________________。
(3)反应开始后,c中先有淡黄色浑浊产生后又变为澄清,此浑浊物______(填化学式)。
(4)实验结束后,在e处最好连接盛______ (填“NaOH溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______,最后拆除装置。
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________。若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用含磷洗涤剂(含有Na5P3O10)会引起水域含磷量升高,造成环境污染,Na5P3O10中磷元素的化合价是( )
A. —3 B. +2 C. +3 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组配制0.10mol/LNaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mLNaOH溶液,至少需要称量NaOH固体______g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母)____________。在配制溶液时,当快到达刻度线时如何进行定容操作_____________________。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(3)下列情况会使所配溶液浓度偏低的是(填序号) ________________
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
⑧用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,22.4L苯中含有的碳氢键数目为6NA
B. 标准状况下,22.4LNO与11.2L 的O2组成的混合气体中含有的原子数为3NA
C. 25℃时,pH=1的CH3COOH溶液中含有的H+数目等于0.1NA
D. 已知反应: Cu2S+O2![]() 2Cu+SO2,每生成1molCu转移的电子数为2NA
2Cu+SO2,每生成1molCu转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用化学用语回答下列问题:
(1)用电子式表示二氧化碳分子的形成过程_____;
(2)写出NaOH的电子式______;
Ⅱ.下列物质:①N2 ②H2O2 ③NH3 ④MgCl2 ⑤Na2O2
(3)含有极性键和非极性键的是_____(填序号,下同);
(4)含有非极性键的离子化合物是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个恒容密闭容器中按下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),其他条件不变时,容器I、Ⅱ、Ⅲ中N2O的平衡转化率随温度的变化如图所示。
2N2(g)+O2(g),其他条件不变时,容器I、Ⅱ、Ⅲ中N2O的平衡转化率随温度的变化如图所示。

下列说法正确的是
A. 该反应的正反应放热
B. V3>1>V1
C. 图中A、B、C三点处容器内总压强:p(I)A>P(II)B>P(III)C
D. 容器Ⅳ在470℃(图像中纵向虚线所示温度)进行反应时,起始速率:v(N2O)正>v(N2O)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com