
����Ŀ��S2Cl2��һ���ӷ���Һ�壨�۵㣺��76�棬�е㣺138�棩��������ˮ����ˮ�ⷴӦ����������H2S��SO2��H2SO3��H2SO4�����ʣ����������������ڵ�����ͨ��������������S2Cl2 �� ��ͼ��ʵ������S��Cl2�Ʊ�S2Cl2��װ�ã��г�װ�á�����װ�þ�����ȥ���� 
��1����֪S2Cl2���ӽṹ��H2O2���ƣ���S2Cl2�ķ����й����������ۼ���
��2��װ��a��Ӧ���Լ�Ϊ��װ��d�������� �� ���������� ��
��3����ʵ��IJ���˳��ӦΪ������ű�ʾ���� �ټ���װ��c ��ͨ��Cl2��ͨ����ˮ ��ֹͣͨCl2��ֹͣ����װ��c
��4��ͼ��fװ����Ӧ���õ��Լ�Ϊ �� ������Ϊ ��
��5����S2Cl2��ˮ���������ͨ����ˮ�У����۲쵽���������֤��ˮ����������������ɣ�
���𰸡�
��1��3
��2��ŨH2SO4�������ܣ�ʹ���ɵ�S2Cl2������Һ��
��3���ڢۢ٢ݢܣ���ۢڢ٢ݢܣ�
��4����ʯ�ң�����Cl2β������ֹ�����е�ˮ��ʹS2Cl2ˮ��
��5����ˮ�����
���������⣺��1��S2Cl2���ӽṹ��H2O2���ƣ�S2Cl2������ÿ����ԭ������ԭ��֮�䶼�γ�1�Թ��õ��Ӷԣ���ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�S2Cl2�ṹ��ʽΪ ![]() �����Է����к���3�����ۼ������Դ��ǣ�3����2������Ϣ��֪S2Cl2��ˮˮ�⣬����b�е�����Ӧ�ø����Ũ������a��Ӧ���Լ�ΪŨ���ᣬ������Ϊ��������������۵�ϵͣ����������ڻ���װ��cˮƽ���÷�ֹ���ڵ���������ܣ�dΪ�����ܣ�ʹ���ɵ�S2Cl2������Һ�壬�����ռ��� ���Դ��ǣ�Ũ��������ܣ�ʹ���ɵ�S2Cl2������Һ�壻��3������֮ǰ��ͨ����ˮ������ʼ���ɵ�S2Cl2������ȴҺ���������ֹͣ���Ⱥ�ֹͣͨ������ƽ��������ѹǿ����ֹ����Σ�գ�����ʵ�����˳��Ϊ�ڢۢ٢ݢܣ���ۢڢ٢ݢܣ������Դ��ǣ��ڢۢ٢ݢܣ���ۢڢ٢ݢܣ�����4��Fװ��ʢ�ż�ʯ�ң�����Cl2β������ֹ��Ⱦ��������ֹ�����е�ˮ������e��ʹS2Cl2ˮ�⣻���Դ��ǣ���ʯ�ң�����Cl2β������ֹ��Ⱦ��������ֹ�����е�ˮ����ʹS2Cl2ˮ�⣻��5��S2Cl2����ˮ����ˮ�ⷴӦ����������H2S��SO2��H2SO3��H2SO4�����ʣ�ˮ���������ͨ����ˮ�У�֤��ˮ����������������ɵ���������ˮ����ǣ���Ӧ�Ļ�ѧ����ʽΪ��H2S+Cl2=S��+2HCl��
�����Է����к���3�����ۼ������Դ��ǣ�3����2������Ϣ��֪S2Cl2��ˮˮ�⣬����b�е�����Ӧ�ø����Ũ������a��Ӧ���Լ�ΪŨ���ᣬ������Ϊ��������������۵�ϵͣ����������ڻ���װ��cˮƽ���÷�ֹ���ڵ���������ܣ�dΪ�����ܣ�ʹ���ɵ�S2Cl2������Һ�壬�����ռ��� ���Դ��ǣ�Ũ��������ܣ�ʹ���ɵ�S2Cl2������Һ�壻��3������֮ǰ��ͨ����ˮ������ʼ���ɵ�S2Cl2������ȴҺ���������ֹͣ���Ⱥ�ֹͣͨ������ƽ��������ѹǿ����ֹ����Σ�գ�����ʵ�����˳��Ϊ�ڢۢ٢ݢܣ���ۢڢ٢ݢܣ������Դ��ǣ��ڢۢ٢ݢܣ���ۢڢ٢ݢܣ�����4��Fװ��ʢ�ż�ʯ�ң�����Cl2β������ֹ��Ⱦ��������ֹ�����е�ˮ������e��ʹS2Cl2ˮ�⣻���Դ��ǣ���ʯ�ң�����Cl2β������ֹ��Ⱦ��������ֹ�����е�ˮ����ʹS2Cl2ˮ�⣻��5��S2Cl2����ˮ����ˮ�ⷴӦ����������H2S��SO2��H2SO3��H2SO4�����ʣ�ˮ���������ͨ����ˮ�У�֤��ˮ����������������ɵ���������ˮ����ǣ���Ӧ�Ļ�ѧ����ʽΪ��H2S+Cl2=S��+2HCl��
���Դ��ǣ���ˮ����ǣ�


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д� Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�����ᴿ��ʵ���У���ѡ�õķ�������������ȷ���ǣ� ��
��� | A | B | C | D |
ʵ��Ŀ�� | ��ȡ����ˮ | ����ˮ��ֲ���� | ����ʳ��ˮ����ɳ | ��Ũʳ��ˮ�еõ��Ȼ��ƾ��� |
���뷽�� | ���� | ��Һ | ��ȡ | ���� |
ѡ������ |
|
|
|
|
A.ѡ��A
B.ѡ��B
C.ѡ��C
D.ѡ��D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣����еĢ�~����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش�
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� |
��1������ЩԪ���У���ѧ��������õ�ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ___________��
��2���ؿ��к������Ľ���Ԫ����____________________________��
��3��������γɵĻ�����ĵ���ʽ______________________________��
��4����ЩԪ���е�����������Ӧ��ˮ�����У�������ǿ����___________��������ǿ����____________�������Ե�����������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����Ԫ�����ڱ���ͬһ���������Ԫ�أ�����ԭ������Ϊx�����ҵ�ԭ�������������� ( )
A.x��2B.x��4C.x��8D.x��18
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��һ�ֳ�����Ԫ�أ����Զ�����ʽ�㷺��������Ȼ��֮�С�
��1���Ǽʿռ���ڶ����л����Ӻ������ӣ�����������̼Ԫ�أ�C2��һ���Ǽʷ��ӣ�C2��C60��Ϊ_______________��
��2��CO2��̼Ԫ����Ҫ��������ش������й����⣺
������CO2��Na2O2��Ӧ���������������ṩ�������䷴Ӧ����ʽΪ_________________��
�ڹ�ҵ�Ͽ���CO2��NH3��һ�������ºϳ����أ���Ӧ����ʽΪ2NH3+CO2![]() CO(NH2)2+H2O��
CO(NH2)2+H2O��![]() ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
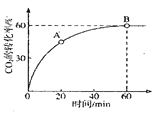
A����淴Ӧ����![]() __________B�������Ӧ����
__________B�������Ӧ����![]() (����ڡ�С�ڡ����ڡ�)��NH3��ƽ��ת����Ϊ____________��
(����ڡ�С�ڡ����ڡ�)��NH3��ƽ��ת����Ϊ____________��
�����ŶԻ���������ʶ�����룬CO2��ת�����������ѳ�Ϊ�����ȵ�֮һ���Ը����������Ķ��Ե缫���������ɵ��CO2ת��ΪCO��װ��ʾ��ͼ���£�
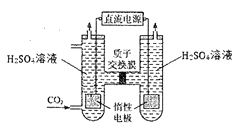
д��ͨCO2��缫��Ӧʽ_________________��
��CO2����������̼�����ϡ���������(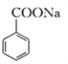 ��дΪC6H5COONa)Ҳ��ijЩ���ϵ����Ӽ��������־����������á��о�����������(C6H5COOH)���־������������ڱ������ơ���������ij���ϵĹ����У��������ӱ��������⣬�����ѹ����CO2���塣������̼��Ķ������룬��д��̼���뱽�����Ʒ�Ӧ�����ӷ���ʽ__________________��������÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______________����ѹ����CO2�����ϵ��־�����������ǿ������������ӷ���ʽ������ԭ��_______________����֪��H2CO3��Ka1��4.17��10��7��C6H5COOH��Ka��6.25��10��5������
��дΪC6H5COONa)Ҳ��ijЩ���ϵ����Ӽ��������־����������á��о�����������(C6H5COOH)���־������������ڱ������ơ���������ij���ϵĹ����У��������ӱ��������⣬�����ѹ����CO2���塣������̼��Ķ������룬��д��̼���뱽�����Ʒ�Ӧ�����ӷ���ʽ__________________��������÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______________����ѹ����CO2�����ϵ��־�����������ǿ������������ӷ���ʽ������ԭ��_______________����֪��H2CO3��Ka1��4.17��10��7��C6H5COOH��Ka��6.25��10��5������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������ת��������AΪ����������CΪ�
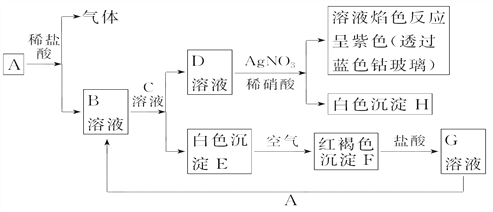
�Իش�
��1��д��F�Ļ�ѧʽ________��H�Ļ�ѧʽ___________________________________��
��2��д����Eת���F�Ļ�ѧ����ʽ��________________________________��
��3����G��Һ����A���йط�Ӧ���ӷ���ʽ��________________________________________��
��4��д��A��һ����������ˮ��Ӧ�Ļ�ѧ����ʽ��_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������м����һ��������ϡ���ᷴӦ���ڶ�������������������Һ��Ӧ�������������������Ϊ1��2�����һ����ڶ�����м��������Ϊ�� ��
A.1��1
B.2��1
C.1��3
D.1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ�������£� �ٸ������ù�����̼��ԭ���������Ƶôֹ裬ͬʱ�õ�һ�ֿ�ȼ�����壻
�ڴֹ�������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2����
SiHCl3+H2����
��SiHCl3�������H2��1 100��1 200����¶��·�Ӧ�Ƶô��裬��֪SiHCl3����ˮ���ҷ�Ӧ���ڿ���������ȼ��
��ش�
��1����һ����ȡ�ֹ�Ļ�ѧ��Ӧ����ʽΪ ��
��2���ֹ���HCl���巴Ӧ��ȫ�������õ���SiHCl3���е�33.0�棩�к�������SiCl4���е�57.6�棩��HCl���е㩁84.7�棩���ᴿSiHCl3���õķ���Ϊ ��
��3��ʵ������SiHCl3�������H2��Ӧ��ȡ����װ����ͼ��ʾ�����Ⱥͼг�װ����ȥ���� 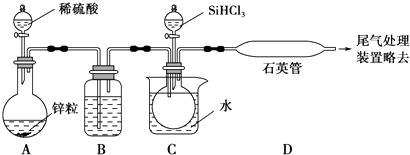
��װ��B�е��Լ��� �� װ��C�е��ձ���Ҫ���ȣ�Ŀ���� ��
�ڷ�Ӧһ��ʱ���װ��D�й۲쵽�������� �� װ��D���ܲ�����ͨ�����ܵ�ԭ���� �� װ��D�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��Ϊ��֤�Ʊ�����ʵ��ijɹ��������Ĺؼ��Ǽ��ʵ��װ�õ������ԣ����ƺ÷�Ӧ�¶��Լ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���Ũ���������п�ķ�Ӧ����̽�������Ȱ�ͼ��װ��ʵ��װ�ã�Ȼ��ȡ20mL18.5mo/L��Ũ������һ����Zn��Ӧ�����Թ�A��ʵ��������ȹ۲쵽C��D�о������ݲ�����D�п�ʼ���ֻ��ǣ�������ʧ��������������٣�Ʒ����Һ��ɫ����Ӧ�ϳ�ʱ���C��D�е��������ֻ��������ӡ��Իش�:
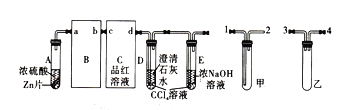
��1���Ӽס�����ѡ����ʵ�װ������B��C�У���������ȷ���ӣ�a��_____��______��b��c��_____��______��d��
��2��A�в�����ʹƷ����Һ��ɫ������Ļ�ѧ����ʽΪ__________________��D��E�Թ���CCl4��Һ��������__________��
��3��D�л�����ʧ�����ӷ���ʽΪ___________________��
��4�����п��ȫ�ܽ⣬����������5.6L(��״��)������Ӧ�����Һϡ�͵�100mL�������Һ��H+Ũ��Ϊ0.4mo/L����Ӧ������п____g����������ijɷּ����֮��Ϊ_______��
��5��������ʵ���в�����SO2ͨ�����Ը��������Һ�У����������Һ��ɫ��������SO2��___(����������������ԭ��������Ư������),��д����Ӧ�����ӷ���ʽ____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com