
【题目】某学习小组对浓硫酸与金属锌的反应进行探究。首先按图组装好实验装置,然后取20mL18.5mo/L的浓硫酸与一定量Zn反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑独消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加。试回答:
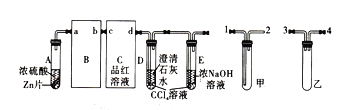
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接_____、______接b,c接_____、______接d。
(2)A中产生能使品红溶液褪色的气体的化学方程式为__________________;D、E试管中CCl4溶液的作用是__________。
(3)D中浑浊消失的离子方程式为___________________。
(4)如果锌完全溶解,共生成气体5.6L(标准状况),将反应后的溶液稀释到100mL,测得溶液中H+浓度为0.4mo/L,则反应共消耗锌____g,生成气体的成分及体积之比为_______。
(5)将上述实验中产生的SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,体现了SO2的___(填“氧化性”“还原性”或“漂白性”),请写出反应的离子方程式____________________。
【答案】 3(或4) 4(或3) 1 2 Zn+2H2SO4(浓)=ZnSO4+SO2 ↑ +2H2O 防止倒吸 SO2+H2O+CaSO3=Ca2++![]() 16.25 V(SO2)∶V (H2)= 2∶3 还原性 5SO2+
16.25 V(SO2)∶V (H2)= 2∶3 还原性 5SO2+![]() +2H2O=
+2H2O=![]() +2Mn2++4H+
+2Mn2++4H+
【解析】试题分析:取20mL18.5mo/L的浓硫酸与一定量Zn反应,微热试管A,实验过程中先观察到C、D中均有气泡产生, D中开始出现浑浊,后浑独消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加。分析以上实验现象可知,浓硫酸与锌反应先生成二氧化硫气体,当硫酸的浓度降低到一定程度后,可以生成氢气。即反应先后可能发生了两个反应,分别是Zn+2H2SO4=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,显然,无论生成的气体是二氧化硫还是氢气,气体的物质的量总是等于消耗锌的物质的量。
(1)分析实验装置可知,B中应选用乙装置,作用是防止倒吸;C中选择甲装置,作用是检验二氧化硫;D也是检验二氧化硫的装置;E是尾气吸收处理装置。几个装置的连接顺序为:a接3(或4)、4(或3)接b,c接1、2接d。
(2)A中产生能使品红溶液褪色的气体的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2 ↑ +2H2O;二氧化硫是极性分子,四氯化碳是非极性分子,根据相似相溶原理可知,D、E试管中CCl4溶液的作用是防止倒吸。
(3)D中浑浊消失的离子方程式为SO2+H2O+CaSO3=Ca2++![]() 。
。
(4)20mL18.5mo/L的浓硫酸中含硫酸的物质的量为0.37mol。锌完全溶解,将反应后的溶液稀释到100mL,测得溶液中H+浓度为0.4mo/L,溶液中含有0.04molH+,则反应后剩余硫酸的物质的量为0.02mol、反应中共消耗0.35mol硫酸。共生成标准状况的气体5.6L,气体的物质的量为0.25mol,根据反应方程式可知,共消耗锌0.25mol,0.25mol锌的质量为16.25g。因为生成1mol SO2消耗2mol硫酸,而生成1mol H2只消耗1mol硫酸,所以气体与硫酸的物质的量之差就是生成SO2的物质的量,则n(SO2)=0.35mol-0.25mol=0.1mol,n(H2)=0.25mol-0.1mol=0.15mol,V(SO2)∶V (H2)=0.1mol∶0.15mol= 2∶3。
(5)将上述实验中产生的SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,体现了SO2的还原性,该反应的离子方程式为5SO2+![]() +2H2O=
+2H2O=![]() +2Mn2++4H+。
+2Mn2++4H+。


科目:高中化学 来源: 题型:
【题目】S2Cl2是一种易挥发的液体(熔点:﹣76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质.它是橡胶硫化剂.在熔融的硫中通以氯气即可生成S2Cl2 . 下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). 
(1)已知S2Cl2分子结构与H2O2相似,则S2Cl2的分子中共含有条共价键.
(2)装置a中应放试剂为;装置d的名称是 , 它的作用是 .
(3)该实验的操作顺序应为(用序号表示). ①加热装置c ②通入Cl2③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)图中f装置中应放置的试剂为 , 其作用为 .
(5)将S2Cl2的水解气体产物通入氯水中,若观察到的现象,则可证明水解产物中有硫化氢生成.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是 ( )
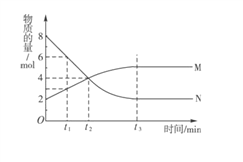
A. 化学方程式为2MN B. t2时,正逆反应速率相等,达到平衡
C. t2时,正反应速率大于逆反应速率 D. t1时,M的浓度是N浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: 2SO2(g)+O2(g)![]() 2SO3(g) △H=-XkJ/mol;
2SO3(g) △H=-XkJ/mol;
2NO(g)+O2(g)![]() 2NO2(g) △H=-YkJ/mol。
2NO2(g) △H=-YkJ/mol。
则反应NO(g)+SO2(g)![]() SO3(g)+NO(g) 的△H=______ kJ/mol。
SO3(g)+NO(g) 的△H=______ kJ/mol。
(2)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出热量222.5kJ,则甲烷燃烧的热化学方程式为____________。
(3)以KOH溶液为电解质溶液,依据(2)中反应设计一个原电池,其负极反应式为_______;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为_________。
(4)以上述甲烷燃料电池为电源,用铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体。则电解后溶液的pH为______(电解过程中溶液体积不变),原混合溶液中Cu2+的物质的量浓度为___________,假设电解过程中能量利用率为80%,在甲烷燃料电池中消耗的甲烷在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物检验方法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B.苯和乙烯都能使溴水褪色,但褪色的原理是不同的
C.用溴水可以鉴别乙烯与乙炔
D.苯和苯的同系物都可以用酸性高锰酸钾溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A. 最终生成白色沉淀 B. 最终生成红褐色沉淀
C. 最终出现灰绿色沉淀 D. 无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.10mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

A. MOH的电离程度:c点大于d点
B. ROH溶液由a点到b点时,  变大
变大
C. pH=10时,MOH和ROH溶液中,c(M+)>c(R+)
D. lg![]() =2时,MOH和ROH两种溶液中,水电离的c(OH-)的比值是1:10
=2时,MOH和ROH两种溶液中,水电离的c(OH-)的比值是1:10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)不变
C. 电池工作一段时间后,乙池溶液的总质量减小
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各物质内既有离子键又有共价键的一组是( )
A.NaOH、H2SO4、(NH4)2SO4B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4D.HCl、Al2O3、MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com